Histologie fonctionnelle de la moelle

1
UE10 – Tissu sanguin.
Mr. Touahri
Date : 25/01/2016 Plage horaire : 10h45 – 12h45
Promo : P2 2015/2016 Enseignant : Mr. Touahri
Ronéistes : AUPERIN Vanille
BENARD Anne-Lyne
Histologie fonctionnelle de la moelle
I. Définition
II. La moelle osseuse
1. Développement embryonnaire
2. Répartition topographique selon l’âge
3. Répartition quantitative
4. Histologie
III. Les cellules souches hématopoïétiques
1. Les cellules souches multipotentes (stem cells)
2. Les précurseurs hématopoïétiques
3. Cinétiques des cellules souches
4. Marqueurs de différenciation des cellules
hématopoïétiques
IV. Régulation de l’Hématopoïèse
1. Facteurs de croissances hématopoïétiques
2. Récepteurs au facteurs de croissance hématopoïétique
3. Mécanisme d’action des facteurs de croissance
4. Régulation négative de l’hématopoïèse
5. Rôle du microenvironnement médullaire

2
I. Définition
L’Hématopoïèse se définit par l’ensemble des mécanismes qui assurent le remplacement continu et régulé
des différentes cellules sanguines :
Ce qui est le plus important c’est la demie vie.
La transfusion de polynucléaires neutrophiles (en cas d’agranulocytose, de neutropénie) ne sert à rien car
leur demi-vie est trop courte contrairement aux globules rouges et plaquettes pour lesquels la transfusion est
nécessaire en cas d’anémie, d’hémorragie. Eventuellement on peut faire une transfusion de PNN s’il y a une
infection importante avec une aplasie.
La myélopoïèse correspond à tout ce qui concerne les globules blancs, les globules rouges, les plaquettes et
les monocytes tandis que la lymphopoïèse reste un peu à part.
II. La moelle osseuse
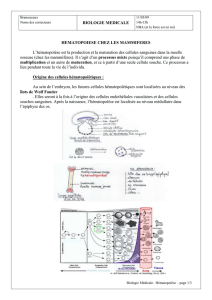
1. Embryologie
• 3ème semaine : ilots érythroblastiques dans le mésoderme,
• 3ème au 6ème mois : érythropoïèse dans le foie et la rate,
• A partir du 6ème mois : hématopoïèse médullaire,
L’hématopoïèse hépatosplénique disparaît à la naissance.

3
Topographie selon l’âge
Chez l’enfant l’hématopoïèse se fait essentiellement au niveau du tibia, du fémur et des côtes alors que chez
l’adulte l’os pelvien (antérieur et postérieur), le sternum et les vertèbres ont la plus grande activité
hématopoïétique. Enfin les côtes gardent leur cellularité à l’âge adulte.
Remarque :
- Localisation importante à savoir lors des radiothérapies pour évaluer les dégâts sur l’hématopoïèse
(Exemple : lors d’une radiothérapie du bassin et du sternum, on touche l’hématopoïèse, il y aura des
problèmes d’aplasie par la suite).
- On peut prélever des cellules au niveau de la moëlle hématopoïétique, les conserver puis les réinjecter au
patient après une chimiothérapie lourde.

4
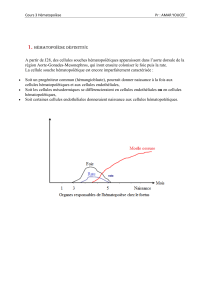
Topographie de l’hématopoïese
Le schéma ci-dessus illustre l’augmentation du volume des cavités osseuses médullaires en fonction du
vieillissement. A 20 ans la masse osseuse est développée. Plus on vieillit, plus on a de la graisse.

5
Répartition quantitative
Retenir 2/3 cellules granuleuses et 1/3 cellules érythroïdes
Les cellules granuleuses correspondent aux polynucléaires neutrophiles, basophiles, éosinophiles ; les
cellules érythroïdes sont les globules rouges ; les cellules mégacaryocytaires sont les plaquettes. Le taux de
plasmocytes doit rester faible (3%).
Le taux de lymphocytes diminue lorsqu’on vieillit. Contrairement à l’enfant, l’adulte a plus de
polynucléaires neutrophiles (environ 70%) et des lymphocytes en moins grande quantité (environ 20-25%).
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
1
/
17
100%