Les facteurs de croissance

Année Universitaire 2010-2011
UE5
Cours du Dr R. GARNOTEL
Les lignées cellulaires : culture de cellules
hématopoïétiques

1 –INTRODUCTION
2 –HEMATOPOIESE
2.1. Les cellules hématopoïétiques
2.2. Régulation de l’hématopoïèse
3 –CULTURES DE CELLULES HEMATOPOIETIQUES
3.1. Culture à partir de cellules souches issues de la
moelle osseuse
3.2. Culture de cellules dérivées de lignées
leucémiques
3.3. Différenciation des monocytes ex vivo

4 –APPLICATIONS
4.1. Cytométrie en flux
4.2. Etudes biochimiques
4.3. Implications fonctionnelles
CONCLUSION

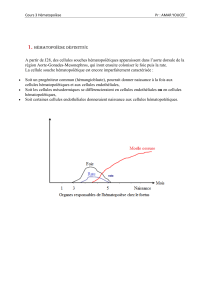
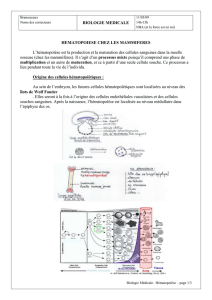
1 –INTRODUCTION
Hématopoïèse : ensemble des mécanismes assurant le
remplacement continu et régulé des différentes cellules
sanguines
Les cellules sanguines comportent 8 lignées différentes :
- hématies
- polynucléaires neutrophiles
- polynucléaires éosinophiles
- polynucléaires basophiles
- monocytes
- lymphocytes B
- lymphocytes T
- plaquettes

 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
1
/
25
100%