Renseignements d`ordonnance (Acétate de potassium 39,2% p/v

Renseignements d’ordonnance
ACÉTATE DE POTASSIUM INJECTION USP
(Acétate de potassium 39,2% p/v)
Appoint électrolytique
Ne pas directement injecter. Doit être dilué avant usage.
Ne pas distribuer directement au patient.
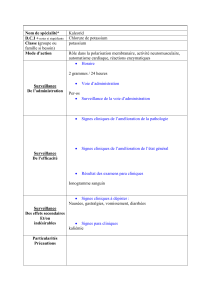
Information sommaire du produit
Voie d’administration
Forme posologique/
concentration
Ingrédients non-médicinaux
cliniquement pertinents
Intraveineuse après dilution
Fioles à bouchon articulé
de 50 mL d’acétate de
potassium 4 mEq/mL
Aucun
Indications :
L’acétate de potassium injection USP doit seulement être administré sous surveillance
médicale.
L’acétate de potassium injection USP est indiqué comme additif dans de grands volumes de
liquides intraveineux pour le remplacement et le maintien de la kaliémie normale lorsqu’une
source d’acétate est également nécessaire ou lorsque le chlorure de potassium est à proscrire.
Contre-indications
Hyperkaliémie;
Maladies ou conditions prédisposant à l’hyperkaliémie.
Mises en garde et précautions:
L’acétate de potassium injection USP doit être dilué avant l’administration.
Les liquides administrés en périphérie par voie intraveineuse ne doivent pas contenir plus de
20 mmol/L de potassium. Le potassium ne doit pas être perfusé à un taux plus grand que 10
mmol/heure sans surveillance cardiaque lors de soins critiques. La concentration sérique de
potassium n’est pas un indicateur fiable du contenu corporel total en potassium.
Une concentration sanguine anormalement élevée ou faible de potassium est associée à une
toxicité pouvant être sévère et potentiellement létale.

Lors de situations où un déficit important de potassium doit être corrigé d’urgence, une
surveillance cardiaque continue ainsi que des mesures de la concentration de potassium
sérique doivent être appliquées afin de réduire le risque d’arythmies cardiaques et de mort
subite.
Les solutions ou les produits contenant de l’acétate doivent être administrés avec prudence
chez les patients atteints d’alcalose métabolique ou respiratoire. L’acétate doit être administré
prudemment lors de conditions dans lesquelles l’usage d’acétate est affecté, telle que lors
d’insuffisance hépatique sévère.
Utiliser prudemment lorsqu’en présence de maladies cardiaques, particulièrement chez les
patients chez qui des digitaliques ont été administrés ou en présence de maladies rénales.
Pharmacologie : Étant le principal cation du liquide intracellulaire, le potassium joue un rôle
important dans l’équilibre hydro-électrolytique. La concentration normale de potassium dans
le compartiment du liquide intracellulaire est d’environ 160 mEq/L. La variation normale de
potassium sérique est de 3,5 à 5 mEq/L. L’homéostasie du potassium est régulée
principalement par le rein. Le taux quotidien de potassium chez le commun des adultes
moyenne 50 à 150 mEq et représente 1,5 à 5% de la teneur totale en potassium du corps.
Acétate (CH3COO-), une source d’accepteurs d’ions d’hydrogène, est une autre source de
bicarbonate (HCO3-) et la principale source d’acétoacétate entrant dans le cycle de Krebs.
L’acétate est métabolisé dans le foie, dans le muscle et dans d’autres tissus.
Effets indésirables :
L’administration d’acétate de potassium peut causer une hyperkaliémie si infusée à un taux
plus grand que celui du transport des ions potassium vers le liquide intracellulaire.
Les signes et symptômes de l’hyperkaliémie incluent : paresthésie des extrémités, paralysie
flasque, lassitude, confusion, faiblesse et lourdeur des jambes, hypotension, arythmie
cardiaque, blocage cardiaque, anomalies électrocardiographiques telle que la disparition de
l’onde P, étalement et allongement du complexe QRS par le développement d’une courbe
biphasique et arrêt cardio-circulatoire. (voir Mises en garde et précautions)
Vous pouvez signaler tout effet secondaire soupçonné associé avec l’utilisation d’un
produit de santé au Programme Canada Vigilance via l’une des trois façons suivantes :
En ligne: www.healthcanada.gc.ca/medeffect
Téléphone (sans frais) : 1-866-234-2345
Compléter un formulaire de signalement de Canada Vigilance et :
Faire une télécopie sans frais à 1-866-678-6789, ou
par courrier régulier à : Programme Canada Vigilance
Santé Canada
Case postale 0701C
Ottawa, Ontario

K1A 0K9
Les étiquettes préaffranchies, le formulaire de signalement de Canada Vigilance
ainsi que les guides concernant le signalement d’effets adverses sont disponibles
sur le site web de MedEffectTM Canada au www.healthcanada.gc.ca/medeffect.
REMARQUE : Si vous avez besoin d’information concernant la gestion d’effets
adverses, veuillez contacter votre médecin. À noter que le programme
Canada Vigilance ne donne pas de renseignements médicaux.
Surdosage :
En cas de surdosage, interrompre immédiatement la perfusion contenant du potassium. En
cas de modification de l’ECG, administrer du chlorure de calcium ou du gluconate de calcium
immédiatement. Un traitement afin de déplacer le potassium dans le compartiment
intracellulaire, telle que l’administration de glucose ou d’insuline, peut être utilisé lors de la
préparation de traitements additionnels spécifiquement dans le but de retirer le potassium du
corps, telles qu’une dialyse ou des résines échangeuses d’ions. Si des irrégularités
électrolytiques ou acido-basiques sont présentes simultanément, elles doivent également être
traitées.
Posologie:
L'acétate de potassium s’administre par voie intraveineuse et uniquement après sa dilution
dans une perfusion de grand volume. La dose et la vitesse de perfusion sont dictées par les
besoins particuliers du patient. L’ECG et le potassium sérique doivent être contrôlés pour
servir de guide pour l’établissement de la posologie. Selon une technique aseptique, ajouter
une fraction ou le contenu entier d’une ou de plusieurs fioles à un liquide pour perfusion
intraveineuse, afin de fournir le nombre requis de milliéquivalents (mEq) de potassium (K+) et
un nombre égal de milliéquivalents d'acétate (CH3COO-).
L’acétate de potassium injection USP en fiole doit faire l’objet d’une inspection visuelle
permettant de déceler toute présence de particules, de coloration anormale et de fuite. La
clarté et la présence de turbidité et de particules doivent être vérifiées lors de la préparation de
la solution diluée. Le produit ne contient aucun agent de conservation et doit être utilisé
immédiatement. Jeter toute portion inutilisée. Ne pas injecter directement. Utiliser
seulement en pharmacie.
Composition :
Chaque mL de solution concentrée stérile, apyrogène contient de l’acétate de potassium
anhydre 392 mg (4 mmol équivalent à 4 mEq) et de l’eau pour injection USP. Peut également
contenir de l’acide acétique pour l’ajustement du pH (5,5 à 8). Osmolarité : 8 mOsm/mL. Ne
contient aucun agent bactériostatique, antimicrobien ou de tampon ajouté.
Disponibilité : Fioles de verre USP type I à fermeture amovible de 50 mL, boîtes de 10,
incluant un bouchon en caoutchouc et une capsule d’aluminium.

Comment le conserver : Entreposer entre 15 et 30°C. Protéger du gel.
Pour de plus amples informations : Ce document, préparé à l’intention des professionnels
de la santé, peut être obtenu en contactant le manufacturier, les Laboratoires Oméga Ltée, aux
coordonnées ci-dessous:
Par téléphone : (514) 335-0310 ou 1-800-363-0584
Par courrier: Laboratoires Oméga Ltée
11 177 Hamon
Montréal (Québec)
H3M 3A2
Par internet : www.omegalaboratory.com
Ce feuillet a été préparé par les Laboratoires Oméga Ltée.
Montréal, Canada H3M 3A2 Date de préparation: 8 novembre 2010
1
/
4
100%