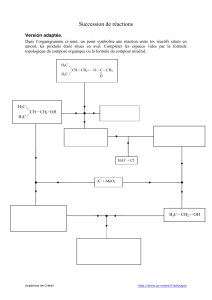
+ CH + H - Le Repaire des Sciences

Chimie – Terminale S
Chapitre 8
Correction des exercices
1
Estérification et hydrolyse
Corrigé des exercices
Exercice 11 p. 203
Exercice 18 p. 204
1.
2. Le blocage cinétique permet d’arrêter la réaction au moment choisi et d’éviter, ainsi, que la réaction
inverse (estérification) se produise et ne modifie la réaction étudiée. Ce blocage est réalisé en plongeant le
mélange réactionnel dans un bain d’eau glacée (mélange eau – glace et sel éventuel).
3. a. Le titrage de 10 mL de mélange réactionnel par de la soude à 2,00 M donne un volume équivalent VE
= 17,6 mL. On a donc 3 2
2,00 17,6.10 3,52.10
A B E
n c V mol
. Pour les 180 mL de mélange
réactionnel, on a donc
2
18 3,52.10 0,634
n acide formé mol
.
b. Ainsi, xf = 0,634 mol. L’avancement maximal correspond à la consommation totale de l’ester, soit
xmax = 1 mol.
c. Le rendement de la réaction est ici de 0,634
0,634
1
.
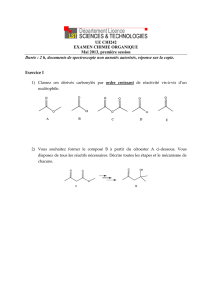
H COOH
+
CH3CH2OH CH3COO CH2CH3
+
H2O
acide méthanoïque propanol méthanoate de propyle
CH2COOHCH3
+
CH3(CH2)3OH CH2COO (CH2)3CH3
CH3
+
H2O
acide propanoïque butan-1-ol propanoate de butyle
CH COOHCH3
CH3
+
CH3OH CH COO CH3
CH3
CH3
+
H2O
acide 2-méthylpropanoïque méthanol propanoate de butyle
+
CH3HC CH2
CH3
OH
+
H2O
acide benzoïque 2-méthylpropan-1-ol benzoate de 2-méthylpropyle
COOH COO CH2CH
C
H
3
CH3
+ +
éthanoate d'éthyle acide éthanoïque éthanol
CH3COO CH2CH3H2OCH3COOH CH3CH2OH

Chimie – Terminale S
Chapitre 8
Correction des exercices
2
4. Le rendement obtenu ici est donc près de deux fois supérieur à celui obtenu lorsque les réactifs sont
dans les proportions stœchiométriques : par conséquent, placer l’un des réactifs en excès (ici l’eau)
permet d’augmenter le rendement de la réaction.
Exercice 20 p. 205
1. La transformation (estérification) est lente et limitée.
2. a. acide ayant réagi acide initial acide restant 0,80
e A
n n n n n
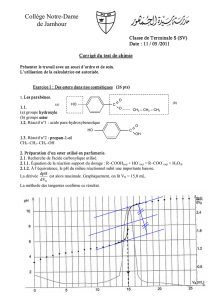
t (min) 10 20 30 40 50 80 120 150
nA (mol) 0,60 0,48 0,39 0,33 0,28 0,22 0,21 0,20
ne (mol) 0,20 0,31 0,41 0,47 0,52 0,58 0,59 0,60
3.a. xmax = 0,80 mol : correspond à la disparition totale des réactifs (mélange stœchiométrique). En
revanche, le graphique semble indiquer que xéq = 0,60 mol
b. xéq < xmax. La réaction est donc bien limitée.
c. Le rendement s’écrit ici
max
0,60
0,75
0,80
éq
x
x
.
4. On peut déplacer l’équilibre dans le sens de production de l’ester en éliminant l’eau (par un dispositif
de Dean-Stark par exemple) ou en plaçant l’un des réactifs (acide ou alcool) en excès.
+ +
éthanoate d'éthyle
acide éthanoïque éthanol
CH3COO CH2CH3H2O
CH3COOH CH3CH2OH
ne = f(t)
0
0,1
0,2
0,3
0,4
0,5
0,6
0,7
0 20 40 60 80 100 120
t(min)
ne (mol)

Chimie – Terminale S
Chapitre 8
Correction des exercices
3
Exercice 21 p 206
I.1. L’estérification est lente et limitée.
2.a. H2SO4 est un catalyseur.
b. La pierre ponce sert à homogénéiser le milieu réactionnel pendant le chauffage.
c. Les facteurs cinétiques sont le catalyseur et la température élevée.
3. a. Le chauffage à reflux est un chauffage sans perte de réactifs ni de produits par évaporation. Les
substances s’évaporent lors du chauffage, se condensent puis retombent dans le milieu réactionnel grâce
au condenseur vertical. b. Montage c.
II. 1. a. n(acide) = m(acide)/ M(acide) = 12,2 / 122,0 = 0,100 mol
n(alcool) = m(alcool)/ M(alcool) = (alcool) V(alcool)/ M(alcool) = 0,80 40/32,0 = 1,0 mol
b. voir tableau d’avancement : xmax = n(acide) = 0,100 mol. L’alcool est en excès à de déplacer l’équilibre
dans le sens direct et d’augmenter le rendement.
2. a. Phase aqueuse en haut et phase organique en bas.
b. m(ester) théorique = xmax M(ester) = 0,100 136,0 = 13,6 g
c. = m(ester) expérimentale/m(ester) théorique = 10,2/13,6 = 0,750 = 75,0 %
Exercice 25 p 208
I.1. a. 3-méthylbutan-1-ol
b. c. voir au dos.
d. Estérification qui est une réaction lente et limitée.
II. 1.a. voir livre p 254
b. Pour augmenter la vitesse de la réaction car la température est un facteur cinétique.
Pour éviter la perte de réactifs et de produits. Voir ex 21 p 206 question 3.a.
c. Le catalyseur augmente la vitesse de la réaction. Son volume peut être non précis.
2.a. n(acide) = m(acide)/ M(acide) = 16/60,0 = 2,7.10-1 mol et n(alcool) = m(alcool)/ M(alcool) = 8,0/88,0 = 9,1.10-2 mol
b. Excès d’acide pour déplacer l’équilibre dans le sens direct et augmenter le rendement de la réaction.
3. m(ester) théorique = xmax M(ester) = 9,1.10-2 130,0 = 12 g
c. = m(ester) expérimentale/m(ester) théorique = 10/12 = 0,83 = 83 %
1
/
3
100%