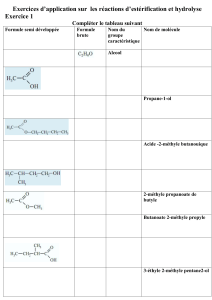
C1_esterification.rtf

Académie de Créteil http://www.ac-creteil.fr/physique
Estérification
Version adaptée.
1. Comment la notion d’équilibre chimique permet-elle d’interpréter le caractère limité de la réaction
d’estérification ?
2. Pour quelle raison cette réaction est-elle souvent réalisée en présence d’acide sulfurique ?
3. On dispose des informations suivantes :
- Réaction d’un mélange équimolaire d’acide carboxylique et d’alcool : le rendement à l’équilibre
est de 67% pour un alcool primaire, de 60% pour un alcool secondaire et de 5% pour un alcool
tertiaire ;
- Réaction d’un mélange pour lequel la quantité de matière initiale d’un réactif (quel qu’il soit)
est double de celle de l’autre : le rendement à l’équilibre est de 84% dans le cas d’un alcool
primaire.
Le tableau ci-dessous donne les conditions de 7 expériences, toutes réalisées à 70°C.
Expérience
A
B
C
D
E
F
G
Quantité initiale d’acide/mol
2
2
2
2
1
2
2
Quantité initiale d’alcool primaire/mol
2
-
1
4
1
-
-
Quantité initiale d’alcool secondaire/mol
-
2
-
-
-
2
-
Quantité initiale d’alcool tertiaire/mol
-
-
-
-
-
-
2
Présence d’acide sulfurique
oui
oui
oui
oui
oui
non
oui
Les graphes ci-dessous donnent l’évolution de la quantité d’ester formé en fonction du temps pour
chaque expérience.
En justifiant les réponses, associer chaque expérience à son graphe.
4. Lors d’une nouvelle expérience, on réalise le mélange réactionnel suivant : 2 moles de propanaoate
d’éthyle (H3C-CH2-COO-CH2-CH3), 2 moles d’eau en présence d’acide sulfurique.
4.1 Ecrire l’équation chimique associée à la réaction en utilisant les formules semi-développées.
4.2 Quelle est la composition du mélange dans l’état final ?
Réponses :
1. Car la réaction inverse se produit simultanément, ce qui conduit à un état d’équilibre (dans lequel
ces deux réactions se produisent à la même vitesse).

Académie de Créteil http://www.ac-creteil.fr/physique
2. La réaction est lente ; elle est catalysée par les ions oxonium.
3. A4 ;B7 ;C1 ;D3 ;E2 ;F5 ;G6.
4.
n(propanoate d’éthyle) = n(eau) = 4/3 mol ; n(acide propanoïque) = n(éthanol) = 2/3 mol.
Version initiale
1. La réaction d’estérification est une réaction limitée. Pourquoi ? Pour quelle raison cette réaction est-
elle souvent réalisée en présence d’acide sulfurique ?
2. On dispose des informations suivantes :
- Réaction d’un mélange équimolaire d’acide carboxylique et d’alcool : le rendement à l’équilibre
est de 67% pour un alcool primaire, de 60% pour un alcool secondaire et de 5% pour un alcool
tertiaire ;
- Réaction d’un mélange pour lequel la quantité de matière initiale d’un réactif (quel qu’il soit)
est double de celle de l’autre : le rendement à l’équilibre est de 84% dans le cas d’un alcool
primaire.
Le tableau ci-dessous donne les conditions de 7 expériences, toutes réalisées à 70°C.
Expérience
A
B
C
D
E
F
G
Quantité initiale d’acide/mol
2
2
2
2
1
2
2
Quantité initiale d’alcool primaire/mol
2
-
1
4
1
-
-
Quantité initiale d’alcool secondaire/mol
-
2
-
-
-
2
-
Quantité initiale d’alcool tertiaire/mol
-
-
-
-
-
-
2
Présence d’acide sulfurique
oui
oui
oui
oui
oui
non
oui
Les graphes ci-dessous donnent l’évolution de la quantité d’ester formé en fonction du temps pour
chaque expérience.
En justifiant les réponses, associer chaque expérience à son graphe.
Adaptations.
Questions 1 et 2. Eviter de tester plusieurs compétences dans la même question.
Questions 4. Questions ajoutées pour vérifier l’acquisition de compétences exigibles.
+H2O =
H3C CH2C
O
O CH2CH3+ H3C CH2OHH3C CH2C
O
OH
1
/
2
100%