Myasthénie

Proposée sous forme de classeur pour faciliter l'accès et la mise
à jour des informations, chaque monographie Myoline rassemble
les connaissances scientifiques, médicales et psychosociales
sur une maladie neuromusculaire.
Regroupés en chapitres repérés par des intercalaires, les textes
développent les informations utiles pour les professionnels
médicaux et paramédicaux qui font le diagnostic, suivent et
traitent des personnes atteintes de maladie neuromusculaire.
La définition donne une idée synthétique de la maladie. Les
textes sont précédé par des résumés en gras. Certains para-
graphes en italique donnent des précisions souvent techniques.
L‘expérience et le vécu des personnes concernées recueillis
au sein de l‘Association Française contre les Myopathies,
viennent enrichir le contenu de ces monographies.
La monographie Myoline “Myasthénie” a été rédigée par Cécile JAEGER,
sous la direction d‘Hélène RIVIERE.
Nous remercions tout particulièrement :
le Docteur Sonia BERRIH-AKNIN,
Madame Chantal DAUCHET,
le Docteur Bruno EYMARD,
Madame Mireille FOURNIOL,
le Professeur Philippe GAJDOS,
le Docteur Cyril GAUD,
Le Professeur Jean-Marie WARTER,
qui ont pris le temps et la peine de lire et corriger attentivement le
manuscrit.
MYASTHÉNIE
ASSOCIATION FRANÇAISE CONTRE LES MYOPATHIES
1, rue de l‘Internationale BP59 91002 EVRY cedex
AVANT-PROPOS

SOMMAIRE
●DÉFINITION..................................................................................1-1
● ÉPIDÉMIOLOGIE. .........................................................................2-1
● PHYSIOPATHOLOGIE ...................................................................3-1
■Physiopathologie de la myasthénie de l’adulte........................3-1
Généralités
Rôle des Ac anti RACh
Origine de la myasthénie
Rôle du thymus
Autres anomalies immunologiques.
Myasthénie séronégative
■Physiopathologie de la myasthénie néonatale....................... 3-5
● DESCRIPTION DE LA MYASTHÉNIE ACQUISE AUTO-IMMUNE ... 4-1
■Appareil musculaire.................................................................4-2
Description clinique
(évolution de l'atteinte musculaire, facteurspronostiques)
Examens complémentaires
(électromyographie, dosage des anticorps,
tests pharmacologiques aux anticholinestérasiques,
biopsie musculaire)
■Appareil respiratoire..............................................................4-10
Description clinique
(la décompensation respiratoire,les infections respiratoires,
l’influence du sommeil)
Examens complémentaires
(radiographie pulmonaire, explorations fonctionnelles
respiratoires, gaz du sang,scanner thoracique)
■Psychologie............................................................................4-12
■Glandes endocrines. ..............................................................4-13
Thymus
Thyroïde
■Appareil digestif ....................................................................4-13
■Gynécologie...........................................................................4-13
Myasthénie et menstruations
Myasthénie et contraception
■Appareil cardio-vasculaire .....................................................4-14
Description clinique
Examens complémentaires
●MYASTHÉNIE ●MAI 1993 ●AFM
MYASTHÉNIE

●DESCRIPTION DES FORMES CLINIQUES......................................5-1
■Myasthénie néonatale..............................................................5-1
■Myasthénie infantile et juvénile...............................................5-2
■Myasthénie et grossesse..........................................................5-3
Pendant la grossesse
Lors de l'accouchement
En post partum
■Myasthénie familiale................................................................5-4
■Myasthénie oculaire.................................................................5-4
■Myasthénie induite par la D-Pénicillamine...............................5-4
●GENETIQUE .................................................................................6-1
●DIAGNOSTIC DIFFERENTIEL ........................................................7-1
■Affections neurologiques ou psychiatriques............................7-2
Sclérose en plaque
Sclérose latérale amyotrophique
Neuropathies périphériques
Paralysies périodiques
Neurasthénie
■Syndromes myasthéniformes. .................................................7-2
Myopathies
Syndrome de Lambert-Eaton
Syndromes myasthéniques congénitaux
Endocrinopathies
■Intoxications ............................................................................7-4
Le botulisme
Autres intoxications
●PRISE EN CHARGE.......................................................................8-1
■Surveillance.............................................................................8-2
■Prévention des complications..................................................8-2
■Contre-indications médicamenteuses ......................................8-3
Contre-indications absolues
Contre-indications relatives
■Traitement de la myasthénie acquise auto-immune ................8-4
Traitement médicamenteux
(les inhibiteurs de la cholinestérase ou anti-cholinestérasiques,
les corticoïdes, les drogues cytotoxiques, les traitements
adjuvants, les perspectives d'avenir)
Thymectomie
Echanges plasmatiques
Immunoglobulines
■Traitement de la décompensation respiratoire ......................8-11
Mesures de réanimation
Ventilation assistée
■Traitement de la myasthénie chez la femme enceinte............8-12
■Traitement de la myasthénie néonatale transitoire................8-13

■Traitement de la myasthénie infantile et juvénile ..................8-14
■Traitement de la myasthénie oculaire....................................8-14
■Traitement de la myasthénie induite par la D-Pénicillamine..8-14
■Précautions en cas d’intervention chirurgicale ......................8-15
En pré-opératoire
En per-opératoire
En post-opératoire
●PATHOLOGIES ASSOCIEES..........................................................9-1
■Myasthénie et thymome. .........................................................9-1
■Myasthénie et maladies auto-immunes. ..................................9-2
■Myasthénie et pathologies non auto-immunes. .......................9-3
●DROIT ET INSERTION.................................................................10-1
■Droit.......................................................................................10-1
Le remboursement des frais médicaux
Les commissions
Les cartes d’invalidité et de station debout pénible
Les allocations
Les exonérations. Les abattements
Les transports
Les aides à domicile
Assurance vieillesse des personnes au foyer
■Etudes et formation professionnelle ......................................10-4
Les transports scolaires et universitaires
Les examens. L’aménagement des épreuves
L’aménagement des études supérieures
L’orientation professionnelle
■Travail....................................................................................10-5
Les négociations avec l’employeur
La reconnaissance de travailleur handicapé
La recherche d’un emploi
Le travail en milieu ordinaire de production
Le travail en milieu protégé
L’Allocation Compensatrice pour
Frais Professionnels (ACFP)
Le reclassement professionnel
La cessation de l’activité professionnelle
La pension d’invalidité
● RECHERCHE ...............................................................................11-1
■Réalisation d’un modèle animal expérimental. ......................11-1
■Origine de la réponse auto-immune et rôle du thymus..........11-2
● CRITERÈS DE DIAGNOSTIC........................................................12-1
● BIBLIOGRAPHIE .........................................................................13-1
● ABRÉVIATIONS ..........................................................................14-1
●MYASTHÉNIE ●MAI 1993 ●AFM

1-1
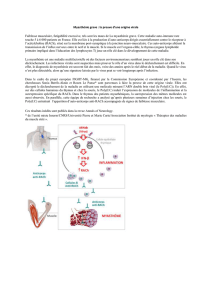
DÉFINITION
La myasthénie est une maladie neuro-
musculaire chronique liée à un défaut de trans-
mission de l’influx nerveux entre le nerf et le
muscle.
Cette anomalie de la transmission neuromus-
culaire est limitée aux muscles dont la com-
mande est volontaire.
Elle atteint les deux sexes et peut débuter à
n’importe quel âge. On observe une plus gran-
de fréquence de début chez la femme entre 20
et 40 ans, et chez l’homme après 40 ans.
C’est une maladie relativement rare (4 à 6 cas
pour 100 000 habitants), de type auto-immun,
dont la physiopathologie, grâce à d’importantes
découvertes, commence à être mieux connue. La
plupart des sujets myasthéniques sont porteurs
d’auto-anticorps se fixant sur les récepteurs de
l’acétylcholine situés sur la membrane post-
synaptique de la jonction neuro-musculaire. Des
anomalies du thymus sont fréquemment retrou-
vées dans la myasthénie.
La myasthénie est caractérisée par une faibles-
se musculaire qui s’aggrave à l’effort. Généra-
lement, cette faiblesse musculaire est peu impor-
tante le matin, puis augmente dans la journée.
Le repos entraîne une amélioration de la force
musculaire. Cependant, dans les formes graves
de la maladie, la force musculaire est diminuée
en permanence et ne s’améliore pas, même après
un repos prolongé.
Les premiers symptômes peuvent survenir après
un choc émotionnel, une infection, une inter-
vention chirurgicale, ou l’administration de sub-
stances bloquant la conduction neuromusculai-
re. Une notion de myasthénie familiale est
retrouvée dans moins de 5% des cas.
Le début est insidieux et la reconnaissance des
premiers signes peut être difficile. Dans près de
la moitié des cas, les premiers signes sont ocu-
laires, avec une diplopie ou un ptosis. Dans les
●MYASTHÉNIE ●MAI 1993 ●AFM
DÉFINITION
MYASTHÉNIE
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
 58
58
 59
59
 60
60
 61
61
 62
62
 63
63
 64
64
 65
65
 66
66
 67
67
 68
68
 69
69
 70
70
 71
71
 72
72
 73
73
 74
74
 75
75
 76
76
1
/
76
100%