Myasthénie

Collège des Enseignants en Neurologie
Myasthénie
I. Pour comprendre
II. Myasthénie
III. Syndrome myasthénique de Lambert-Eaton
IV. Autres anomalies de la transmission neuromusculaire
Objectifs pédagogiques
Nationaux
Diagnostiquer une myasthénie.
CEN
Connaissances requises
Connaître les principaux éléments physiopathologiques de la myasthénie.
Citer les symptômes révélateurs les plus fréquents et les plus évocateurs.
Citer les principaux arguments (cliniques et paracliniques) du diagnostic.
Citer les complications graves.
Connaître les principes du traitement (traitement symptomatique, traitement de fond, médicaments
prohibés).
Savoir que certains médicaments sont prohibés.
Objectifs pratiques
Chez un patient réel ou simulé atteint de myasthénie :
conduire l’interrogatoire et l’examen clinique ;
confirmer le diagnostic.
Évoquer le diagnostic de myasthénie sur un ou des cas vidéoscopés.
I. Pour comprendre
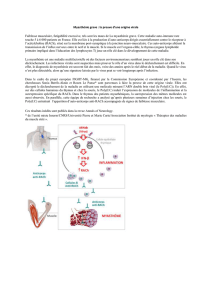
Myasthénie (ou myasthenia gravis) :
maladie auto-immune liée à un blocage des récepteurs de la plaque motrice par des anticorps
anti-récepteurs de l’acétylcholine ou d’autres types d’anticorps : c’est un bloc postsynaptique ;
la responsabilité du thymus est importante : les récepteurs de l’acétylcholine des cellules myoïdes
du thymus entraîneraient la stimulation d’anticorps contre les récepteurs de la jonction
neuromusculaire ; le thymus serait une source de lymphocytes T helper stimulant la production de
ces anticorps par les lymphocytes B ;
elle atteint surtout des adultes ;
entre 20 et 30 ans, elle est plus fréquente chez la femme que chez l’homme (dans une proportion
de 3 pour 2), alors qu’au-dessus de 60 ans les cas masculins sont les plus fréquents.
Syndrome myasthénique de Lambert-Eaton :
maladie auto-immune due à des autoanticorps anti-canaux calciques voltage-dépendants et une
insuffisance de libération de l’acétylcholine : c’est un bloc présynaptique ;
surtout chez le sujet de sexe masculin âgé de plus de 40 ans ;
dans 70 % des cas, syndrome paranéoplasique (+++) : 60 % de cancers intrathoraciques, 50 %
de cancers bronchiques à petites cellules, 10 % de cancers différents (rein, vessie) ;
dans 15 % des cas, associé à une autre maladie auto-immune (Biermer, Sjögren…) ;
dans 15 % des cas, syndrome isolé.
II. Myasthénie
A. Diagnostic clinique
Quelquefois évident, le diagnostic est souvent difficile et longtemps méconnu
.
Déficit moteur variable dans le temps (fatigabilité, ou phénomène myasthénique), qui :
apparaît ou augmente à l’effort ;
peut se manifester dans les muscles directement mis en action au cours de l’effort ou à distance
d’eux ;
augmente en fin de journée ;
se corrige au repos.
Ce déficit moteur est sélectif : il prédomine pour certains muscles (ci-après par ordre de fréquence).
1. Muscles oculaires et palpébraux
Ptosis unilatéral au début, qui peut se bilatéraliser par la suite ; il reste habituellement asymétrique (fig.
14.1).
Diplopie, le plus souvent intermittente.
Ptosis et diplopie sont augmentés par la fatigue, la lumière, la fixation d’un objet.
La musculature pupillaire est indemne.
Fig. 14.1 - Ptosis unilatéral droit.

2. Muscles d
’
innervation bulbaire
Troubles de la déglutition, de la phonation et de la mastication.
La voix s’éteint progressivement, devient nasonnée puis inintelligible.
Troubles de la mastication qui apparaissent au cours des repas, le sujet se trouvant parfois dans
l’obligation de soutenir sa mâchoire inférieure avec sa main.
Troubles de la déglutition donnant parfois lieu au rejet des liquides par le nez et pouvant sérieusement
entraver l’alimentation.
Une parésie faciale donnant un faciès atone est souvent associée aux troubles bulbaires.
La fatigabilité des muscles cervicaux est à l’origine d’une chute de la tête en avant ou de douleurs
cervicales liées à un phénomène de contracture.
3. Autres muscles
Muscles des membres : l’atteinte prédomine sur les muscles proximaux, plutôt de la ceinture scapulaire.
Muscles axiaux : extenseurs du tronc avec camptocormie (antéflexion progressive du tronc), muscles
abdominaux.
4. Muscles respiratoires
L
’
atteinte peut conduire à une décompensation ventilatoire rapide : gravité (+++)
.
5. Examen clinique
Il fait apparaître le phénomène myasthénique en utilisant des tests de répétition des mouvements,
comme celui de l
’
abduction répétée des bras, de l
’
accroupissement, de l
’
occlusion des paupières ou de
la fixation latérale prolongée du regard.
L
’
examen peut être normal si les symptômes sont intermittents et s
’
il est réalisé en période
intercritique. Ceci contribue à la difficulté du diagnostic de cette maladie.
6. Évolution
Chronique et capricieuse, par succession irrégulière de poussées et de rémissions, difficile à
schématiser et à prévoir.
Risques vitaux possibles, du fait des crises myasthéniques se manifestant par des troubles
respiratoires, avec dyspnée et encombrement. L’évolution fatale se produit dans plus de deux tiers des
cas malgré la réanimation (cf. infra).
Effet de la grossesse variable mais risque d’aggravation de 30 % en postpartum.
B. Éléments paracliniques du diagnostic
1. Recherche des autoanticorps
Anticorps anti-récepteurs de l’acétylcholine (anti-RAC) :
présents chez 80 % des malades avec myasthénie généralisée et chez 50 % de ceux avec
myasthénie oculaire (cf. infra) ;
pas de corrélation entre le taux d’anticorps et la gravité de la maladie d’un patient à l’autre ;
chez un même sujet, le taux peut fluctuer en fonction de l’évolutivité de la maladie ;
dans les thymomes malins, le taux est très élevé ;
les formes sans anticorps anti-RAC détectés peuvent être liées à d’autres types d’anticorps (anti-
MuSK) ou être une forme dites « séronégatives ».
Anticorps anti-MuSK (protéine tyrosine kinase du récepteur) : 40 % environ des formes sans anticorps
anti-RAC.
Formes séronégatives : pas d’anti-RAC et pas d’anti-MuSK.
2. Recherche de décrément en ENMG (stimulo
-
détection répétitive)
Décrément : diminution de l’amplitude du potentiel évoqué musculaire(≥10%)lors des stimulations
répétées du nerf.
Il apparaît pour des fréquences basses de stimulation (le plus souvent à 3 c/s) et pour la 4e stimulation
(fig. 14.2).
La sensibilité dépend du territoire où on le recherche : plus sensible dans les territoires cliniquement
atteints comme un muscle proximal (trapèze) ou facial.
La sensibilité diagnostique ne dépasse pas 50 à 75 %.
Fig. 14.2 - Décrément à l’ENMG.

Diminution de l
’
amplitude du potentiel évoqué musculaire
lors des stimulations répétées du nerf à basse fréquence.
3. Test thérapeutique aux anticholinestérasiques
À pratiquer en hospitalisation seulement, par crainte d’une crise cholinergique (cf.infra).
Administration de néostigmine (Prostigmine®) : par exemple, 1 à 2 amp. par voie SC de Prostigmine®,
éventuellement associée à 0,5 mg d’atropine pour éviter les effets secondaires intestinaux et une
bradycardie.
La régression ou la disparition des signes neurologiques si elle est franche et rapide (délai d’action
inférieur à 30 minutes) a un grand intérêt diagnostique.
4. Imagerie
Le scanner ou l
’
IRM
thoracique explore la loge thymique à la recherche d
’
un thymome, bénin ou malin,
ou d
’
un thymus hyperplasique résiduel (fig. 14.3).
Fig.
14.3 - Scanner thoracique. Thymus hyperplasique résiduel.
C. Pathologies associées
1. Thymus et myasthénie
Dans 65 % des cas, hyperplasie thymique (thymus macroscopiquement normal mais caractérisé par la
prolifération de follicules germinatifs à centre clair).
Dans 15 % des cas, thymome (tumeur thymique) ; les thymomes peuvent être bénins ou malins et
doivent être opérés.
2. Myasthénie et maladies auto
-
immunes
Affection thyroïdienne : environ 15 % des cas.
Autres associations dans environ 5 % des cas (polyarthrite rhumatoïde, anémie de Biermer, lupus
érythémateux disséminé, etc.).
D. Formes cliniques
1. Formes oculaires de myasthénie
Dans 15 à 20 % des cas.
L’atteinte reste limitée aux muscles oculomoteurs tout au long de l’évolution. Il faut les distinguer d’une
forme oculaire au début qui se généralise ensuite. Ces formes posent essentiellement un problème
fonctionnel.
2. Formes avec anti
-
MuSK
Atteinte bulbaire plus fréquente que dans les autres formes.
Atrophie musculaire des muscles d’innervation bulbaire (langue).
Fréquence des crises myasthéniques et gravité (++).
3. Myasthénie néonatale
Transitoire, elle survient chez 10 à 25 % des enfants de mère myasthénique.
Les symptômes se manifestent très précocement, durant les 24 premières heures de la vie et se
prolongent 2 à 3 semaines, rarement jusqu’à 15 semaines, puis régressent spontanément.
Hypotonie associée à des troubles de la succion, de la déglutition et de la respiration.

E. Traitement
1. Traitement symptomatique
Les anticholinestérasiques prolongent l’action de l’acétylcholine au niveau de la membrane
postsynaptique par blocage réversible de l’acétylcholinestérase : pyridostigmine (Mestinon®),
ambenonium (Mytelase®).
Posologie à augmenter progressivement jusqu’à la dose optimale (efficacité versus effets secondaires).
Durée d’action brève, de 4 à 5 heures, nécessitant des prises répétées dans la journée.
Risque d’une crise cholinergique avec surdosage : effets muscariniques (hypersécrétion bronchique,
intestinale, salivaire et sudorale) et nicotiniques (fasciculations, crampes musculaires).
2. Traitements de fond
Corticothérapie à doses lentement progressives.
Immunosuppresseur : azathioprine (Imurel®) surtout, mycophénolate mofétil (Cellcept®).
Thymectomie : effet bénéfique sur l’évolutivité de la maladie, en particulier chez le sujet jeune de
moins de 40 ans porteur d’une hyperplasie thymique ; également indiquée en cas de thymome.
3. Traitements des poussées évolutives
Immunoglobulines polyvalentes IV (par exemple, 0,4 g/kg par jour pendant 5 jours).
Alternative : échanges plasmatiques (efficacité équivalente).
4. Autres
Tout patient doit porter sur lui une carte de myasthénie et la liste des principaux médicaments interdits
(encadré 14.1).
Prise en charge à 100 % (ALD).
La grossesse est possible sous anticholinestérasiques ; des poussées de la maladie sont possibles dans
le postpartum.
Encadré 14.1
Médicaments contre
-
indiqués
Tous les médicaments susceptibles d’altérer la transmission neuromusculaire sont contre-indiqués au
cours de la myasthénie.
En cas de doute chez un patient, il ne faut pas hésiter à consulter le Vidal pour chercher d’éventuelles
contre-indications ou vérifier la liste des médicaments contre-indiqués remis habituellement au patient
par son médecin spécialiste.
Contre-indications absolues : D-pénicillamine, curarisants, antibiotiques du groupe des aminosides,
colimycine, bacitracine, polymyxine et cycline injectable, bêtabloquants même locaux, phénytoïne,
diphényl-hydantoïne, triméthadione, dantrolène, quinine, quinidine, chloroquine, procaïnamide.
Contre-indications relatives : phénotiazines, carbamazépine, benzodiazépines, neuroleptiques,
vérapamil, lithium, progestérone.
III. Syndrome myasthénique de Lambert
-Eaton
Déficit moteur des membres inférieurs accompagné d’une fatigabilité excessive, sans amyotrophie.
Réflexes faibles ou absents, surtout aux membres inférieurs (ils sont facilités et apparaissent si on les
recherche immédiatement après un effort musculaire).
Des signes d’atteinte céphalique évoquant une myasthénie sont parfois présents (moins fréquents que
dans la myasthénie).
Dysautonomie cholinergique possible (troubles de la motricité pupillaire, de la sudation, des sécrétions
salivaire et lacrymale, impuissance…).
ENMG :
potentiel d’action musculaire au repos d’amplitude très diminuée par rapport à la normale et dont
l’amplitude augmente de plus de 100 % immédiatement après tétanisation ;
stimulation nerveuse répétitive à fréquence rapide (10 à 50 Hz) : incrément toujours supérieur à
100 %.
Anticorps dirigés contre les canaux calcium présynaptiques voltage-dépendants.
Médicaments pour augmenter le nombre de quanta d’acétylcholine libérés : 3–4 diaminopyridine.
Dans les formes paranéoplasiques, l’évolution dépend du traitement du cancer. Dans les autres formes,
un traitement immunosuppresseur ou immunomodulateur peut être proposé comme dans la
myasthénie.
IV. Autres anomalies de la transmission neuromusculaire
A. Botulisme
Il survient après ingestion de conserve avariée contenant une neurotoxine paralysante produite par des
bactéries du genre Clostridium.
12 à 35 heures après l’ingestion : nausées et vomissements, troubles de la vision, diplopie, sécheresse
des muqueuses buccale et trachéale, déficit moteur généralisé à prédominance proximale.
L’évolution peut être grave par la survenue de complications respiratoires.
ENMG : anomalies similaires à celles du syndrome de Lambert-Eaton, témoignant d’un trouble
présynaptique de la libération d’acétylcholine.
B. Autres

CEN - Collège des Enseignants en Neurologie - http://www.cen-neurologie.asso.fr
Venins de serpents.
Intoxication par le magnésium (chez l’insuffisant rénal notamment).
Traitement par D-pénicillamine.
Syndromes myasthéniques congénitaux par anomalie génétique : très rares.
POINTS CLÉS
La myasthénie auto
-
immune est de loin la plus fréquente :
déficit moteur lié à l’effort et fluctuant ;
ptosis, diplopie, voix nasonnée, troubles de la déglutition, muscles de la nuque, ceinture scapulaire ;
diagnostic confirmé par :
la présence d’anticorps anti-récepteurs de l’acétylcholine ou anti-MuSK ;
la présence d’un bloc neuromusculaire à l’ENMG : décrément ;
le test thérapeutique aux anticholinestérasiques (hospitalisation si forme injectable) ;
intérêt de la recherche :
d’une hyperplasie thymique ou d’un thymome (scanner thoracique) ;
d’une autre maladie auto-immune associée ;
traitements :
anticholinestérasiques (Mestinon® ou Mytélase®) ;
thymectomie (sujet jeune et thymome) ;
immunodépresseurs (corticoïdes ou immunosuppresseurs) ;
immunoglobulines IV ou échanges plasmatiques pour passer un cap difficile (crise myasthénique) ;
remettre une liste des médicaments formellement contre-indiqués au malade ;
gravité de l’atteinte de la musculature respiratoire (détresse aiguë : crise myasthénique).
Les autres syndromes myasthéniques sont beaucoup plus rares : syndrome de Lambert
-
Eaton
(souvent paranéoplasique).
1
/
5
100%