COURS Corrigé

LES TRANSPORTS
Lycée des Métiers LEONARD DE VINCI - 2016/2017
C
CO
OM
MM
ME
EN
NT
T
P
PR
RO
OT
TÉ
ÉG
GE
ER
R
U
UN
N
V
VÉ
ÉH
HI
IC
CU
UL
LE
E
C
CO
ON
NT
TR
RE
E
L
LA
A
C
CO
OR
RR
RO
OS
SI
IO
ON
N
?
?
CHIM 5
1re PRO
1TP
S.P.C. / COURS Corrigé
1/2
Lycée des Métiers LEONARD DE VINCI (33) – Laboratoire de Mathématiques Sciences Physiques et Chimiques – C. DUPONT - http://eolipyle.free.fr – 1TP 1617 S CHIM 5 CO-CORRIGE Corrosion.docx – 2016/2017
Objectifs
Connaissances (A SAVOIR)
Capacités (A SAVOIR FAIRE)
Savoir que certains facteurs tels que l’eau, le
dioxygène et le sel favorisent la corrosion.
Savoir qu’un métal s’oxyde.
Savoir qu’une réaction d’oxydoréduction est une
réaction dans laquelle intervient un transfert
d’électrons.
Savoir qu’une oxydation est une perte d’électrons.
Être capable de mettre en évidence
expérimentalement l’influence de certains facteurs
extérieurs sur la corrosion du fer.
Être capable d’identifier dans une réaction donnée
un oxydant et un réducteur.
Être capable de classer expérimentalement des
couples redox.
Être capable de prévoir si une réaction est possible
à partir d’une classification électrochimique.
Être capable d’écrire et équilibrer les demi-
équations.
Être capable d’écrire le bilan de la réaction
d’oxydoréduction.
1. Réaction entre l’air ambiant et le fer
1.1. La corrosion du fer
Dans l’air humide, un clou en fer se recouvre de rouille.
La formation de rouille est plus rapide avec de l’eau salée
et elle ne se produit pas dans l’air sec.
La formation de rouille est une réaction chimique lente.
La rouille est poreuse, elle n’adhère pas au métal : le fer
n’est donc pas protégé et continu à être attaqué en
profondeur jusqu'à disparition totale du fer.
Cette destruction lente est une corrosion.
1.2. Le rôle du dioxygène de l’air
Le dioxygène contenu dans l’air intervient dans la formation
de la rouille (avec la vapeur d’eau de l’air).
L’équation de la réaction chimique s’écrit :
fer + dioxygène + eau rouille
réactifs produit
La rouille est un mélange complexe renfermant différents
oxydes de fer.
2. Oxydoréduction
2.1. Réaction d’oxydoréduction
Une réaction d’oxydoréduction est une réaction faisant intervenir un transfert d’électrons :
Une oxydation est une perte d’électrons.
L’entité qui perd des électrons est un réducteur.
Fe Fe2+ + 2 e-
Réducteur
Une réduction est un gain d’électrons.
L’entité qui gagne des électrons est un oxydant.
Cu2+ + 2 e- Cu
Oxydant
Lors d’une réaction d’oxydoréduction, l’oxydant prend des électrons au réducteur.
Demi-équations électroniques :
Fe Fe2+ + 2 e-
Cu2+ + 2 e- Cu
Équation bilan : Cu2+ + Fe Cu + Fe2+
Oxydant Réducteur

CHIM 5
C
CO
OM
MM
ME
EN
NT
T
P
PR
RO
OT
TÉ
ÉG
GE
ER
R
U
UN
N
V
VÉ
ÉH
HI
IC
CU
UL
LE
E
C
CO
ON
NT
TR
RE
E
L
LA
A
C
CO
OR
RR
RO
OS
SI
IO
ON
N
?
?
1re PRO
1TP
S.P.C. / COURS Corrigé
2/2
Lycée des Métiers LEONARD DE VINCI (33) – Laboratoire de Mathématiques Sciences Physiques et Chimiques – C. DUPONT - http://eolipyle.free.fr – 1TP 1617 S CHIM 5 CO-CORRIGE Corrosion.docx – 2016/2017
2.2. Couple oxydant/réducteur
La notation générale d’un couple oxydant/réducteur est Ox/Red.
Les éléments d’un couple Oxydant/Réducteur sont reliés par la demi-équation électronique :
Ox + n e-
Réduction
Oxydation
Red
(avec n un nombre entier d’électrons)
La réaction peut évoluer dans un sens ou dans l’autre suivant les conditions expérimentales.
2.3. Classification électrochimique
Les couples Oxydant/Réducteur sont
classés selon le pouvoir oxydant de
l’oxydant, ou selon le pouvoir
réducteur du réducteur.
La classification permet de prévoir le
sens d’une réaction entre 2 couples.
La réaction naturelle qui se produit
lorsque deux couples sont en présence
est la réaction entre l’oxydant le plus
fort et le réducteur le plus fort.
La « règle du gamma () » est un
moyen mnémotechnique qui permet
de s’en souvenir :
Pouvoir
oxydant
croissant
Cu2+
Cu
Pouvoir
réducteur
croissant
Le sens de la réaction est :
Cu2+ + Fe Fe2+ + Cu
Fe2+
Fe
3. Corrosion
3.1. Mécanisme chimique de la corrosion
La corrosion s’explique essentiellement par un phénomène de pile.
La corrosion des métaux est la destruction progressive d’un
matériau métallique.
Dans le cas de la pile cuivre/fer, des réactions d’oxydation et de
réduction se produisent aux deux électrodes :
la borne est constituée par le métal le plus réducteur : le fer.
Le fer s’oxyde : Fe Fe2+ + 2 e-
la borne est constituée par le métal le moins réducteur : le cuivre.
Il y a une réduction du dioxygène dissout dans l’eau : 1
2 O2 + H2O 2 OH–
En fin de réaction on obtient la rouille Fe2+ + 2 OH– Fe(OH)2 Fe2O3, H2O
Dans le cas de la pile zinc/fer, le pôle négatif est le zinc et le positif est le fer : c’est le zinc
qui se détruit.
3.2. Protection contre la corrosion
On peut recouvrir le fer d’une fine couche d’un métal plus réducteur que lui (galvanisation).
ou d’un revêtement non métallique (peinture, vernis, laques, film plastique ...).
On peut mettre en présence un métal plus réducteur que le fer (bloc de zinc fixé sous la coque
d’un bateau : c’est le zinc qui est alors détruit).
On peut relier le fer à la borne négative d’une pile (apport de courant par une « contre pile »).
On peut utiliser des inhibiteurs de corrosion (liquide chimique ajouté à l’électrolyte, dans les
radiateurs en fer, par exemple.
Fer
Cuivre
électrons
Fe2+
HO–
1
Électrolyte
Rouille
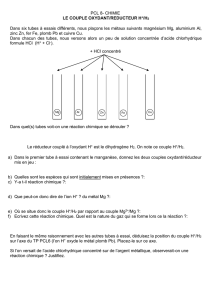
Oxydant
Réducteur
Au3+
Au
Ag+
Ag
Cu2+
Cu
Pb2+
Pb
Sn2+
Sn
Ni2+
Ni
Fe2+
Fe
Zn2+
Zn
Al3+
Al
Mg2+
Mg
Pouvoir
réducteur
croissant
Pouvoir oxydant
croissant
C
Cl
la
as
ss
si
if
fi
ic
ca
at
ti
io
on
n
é
él
le
ec
ct
tr
ro
oc
ch
hi
im
mi
iq
qu
ue
e
d
de
e
q
qu
ue
el
lq
qu
ue
es
s
c
co
ou
up
pl
le
es
s
o
ox
xy
yd
da
an
nt
t/
/r
ré
éd
du
uc
ct
te
eu
ur
r
1
/
2
100%