P_3_oxred_td

Chimie : oxydo-réduction
Bernaud J. 1/2
A°) Répondre par vrai ou faux
1°) Définitions
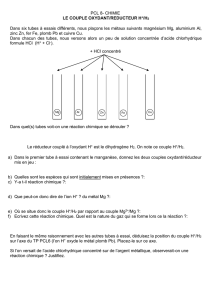
Un oxydant est une espèce chimique pouvant capter un ou plusieurs e-.
Un réducteur est une espèce chimique pouvant donner un ou plusieurs électrons e-.
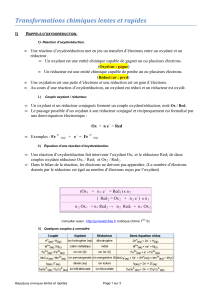
Un couple oxydant/réducteur est constitué d’un oxydant et d’un réducteur, reliés par la
demi-équation électronique : oxydant + n . e- = réducteur
2°) Pour établir l’équation bilan d’un réaction d’oxydoréduction, on peut écrire deux demi-
équations montrant l’échange d’un ou plusieurs e-.
3°) Lors d’une réaction d’oxydoréduction, le réducteur donne un ou plusieurs électrons e- et
devient oxydant.
4°) Lors d’une réaction d’oxydoréduction, l’oxydant capte un ou plusieurs électrons e- et
devient réducteur.
5°) Les métaux sont des réducteurs.
6°) Un réducteur subit une oxydation en donnant un ou plusieurs électrons e-.
7°) Un oxydant subit une réduction en recevant un ou plusieurs électrons e-.
8°) Toutes les équations suivantes traduisent une réaction d’oxydoréduction :
Cu2+ +2 e- = Cu
3 Cu2+ + 2 Al -> 3 Cu + 2 Al3+
2 I- = I2 +2 e-
9°) Avec certains réactifs, l’eau agit comme un oxydant, avec d’autres réactifs l’eau agit
comme un réducteur.
10°) Tous les couples suivants sont des couples oxydant/réducteur :
Zn/Zn2+
H2O/HO-
Cu2+/Cu
B°) Une lame de cuivre trempe dans une solution de nitrate d'argent (97VAL001D, banque
exo Poitiers)
Au bout d’une heure la solution devient :
rouge
bleue
incolore
argentée
La masse de cuivre métallique :
augmente
diminue
ne change pas
Du métal cuivre :
a été dissous
a été rongé
a été oxydé
a été réduit
se dépose sur la lame
C°) Poudre de zinc dans une solution de chlorure de palladium (97VAL007D, banque exo
Poitiers)
On agite de la poudre de zinc dans 200 mL d'une solution à 8,5.10-3 mol.L-1 de chlorure de
palladium ( PdCl2 ). On donne M(Pd) = 106,4 g.mol-1 et M(Cl) = 35,5 g.mol-1.

Chimie : oxydo-réduction
Bernaud J. 2/2
1. L'ion palladium Pd 2+ est réduit par le métal zinc. Ecrire les demi-équations et l'équation-
bilan de la réaction.
2. Le zinc étant en excès, quelle est la masse de métal palladium déposée?
3. La réaction terminée on décante le mélange réactionnel, on filtre et on ajoute au filtrat une
solution d'hydroxyde de sodium à 0,500 mol.L-1.
- Quel est l'aspect et quelle est la nature du précipité observé?
- Ecrire l'équation de la réaction.
- Quel volume minimum de soude faut-il verser pour précipiter la totalité des cations
métalliques ?
D°) BTS2000 : Teinture à l’indigo des blue jeans
Dans un premier temps, l’indigo est réduit en une forme jaune pâle, appelée « indigo blanc »,
soluble dans l’eau. Cette forme peut être fixée par les tissus.
Dans un deuxième temps, le tissu imprégné d’ « indigo blanc » est exposé à l’air ; l’oxydation
de cette forme jaune pâle en la forme bleue colore le tissu en surface.
1°) L’indigo existe donc sous deux formes, la forme oxydée Ind qui est bleue et la forme
réduite IndH2 qui est jaune pâle.
1.1 Qu’est-ce qu’une oxydation ?
1.2 Sous quelle forme l’indigo est-il fixé sur les tissus ?
1.3 Ecrire la demi équation rédox correspondant à ce couple.
2°) Ecrire la demi équation rédox du couple O2 / H2O.
3°) En déduire l’équation-bilan de l’action du dioxygène de l’air sur l’indigo blanc.
1
/
2
100%