Physiologie et physiopathologie des lymphocytes T régulateurs CD4

Mini-revue
Physiologie et physiopathologie
des lymphocytes T régulateurs
CD4
+
CD25
+
Physiology and pathophysiology of CD4
+
CD25
+
regulatory T cells
Olivier Boyer
Serge Jacquot
INSERM U519, Faculté de médecine
et de pharmacie, 22 bd Gambetta,
76183 Rouen, France
<olivier[email protected]>
Résumé.Les années récentes ont vu la réemergence spectaculaire des cellules
suppressives comme des acteurs majeurs du système immunitaire. De nombreux
arguments expérimentaux ont établi de façon convaincante que des cellules
naturellement suppressives, les lymphocytes T CD25
+
CD4
+
régulateurs (Treg),
jouent un rôle central dans le maintien de la tolérance au soi et dans la régulation
des réponses immunitaires. L’identification de marqueurs moléculaires de ces
cellules, tant chez la souris que chez l’homme, a permis de les caractériser et
d’étudier leur rôle en physiologie et dans certaines situations pathologiques. Nous
décrivons ici les principales caractéristiques phénotypiques et fonctionnelles des
Treg, ainsi que les principales maladies autoimmunes dans lesquelles elles ont été
impliquées. Outre leur rôle dans le maintien de la tolérance au soi, les Treg ont
aussi été récemment impliqués dans la tolérance aux allogreffes, et nous discute-
rons de leur intérêt clinique potentiel pour le contrôle de la maladie du greffon
contre l’hôte.
Mots clés : lymphocyte T, lymphocyte T régulateur, Foxp3, maladie autoimmune,
tolérance, maladie du greffon contre l’hôte
Abstract.Recent years have seen the reemergence of suppressor cells as a major
subject of immunological research. Abundant evidence has now convincingly
shown that naturally occurring CD25
+
CD4
+
regulatory cells (Treg) play a key role
in the maintenance of self tolerance and also in the negative control of different
types of immune responses. The identification of molecular markers in both mice
and humans has enabled thorough investigation of these cells. We herein describe
the main phenotypic and functional characteristics of Treg, and review their
dysfunctions in autoimmune diseases. Beside their role in the maintenance of
self-tolerance, Treg have now extended their influence to transplantation tolerance
and we also discuss their clinical potential for the control of graft-versus-host
disease.
Key words: T cell, regulatory T cell, Foxp3, autoimmune disease, tolerance,
graft-versus-host disease
Tolérance
immunologique et petit
historique des Treg
Les étapes du développement des lym-
phocytes T (LyT) dans le thymus sont mar-
quées par des événements aléatoires de
recombinaisons génétiques qui permet-
tent de produire, à partir d’un nombre
restreint de segments géniques, un
répertoire de récepteurs pour l’antigène
(TcR, T cell receptor) d’une diversité
Tirés à part :
O. Boyer
Hématologie 2006 ; 12 (3) : 164-70
Hématologie, vol. 12, n° 3, mai-juin 2006
164
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 25/05/2017.

considérable donc susceptible de contenir des LyT reconnais-
sant des antigènes du soi (autoréactifs). Ce répertoire est
modelé par des phénomènes de sélection positive et de sélec-
tion négative. La sélection positive est le processus par lequel
des précurseurs de LyT capables de reconnaître des complexes
peptides - molécules du complexe majeur d’histocompatibilité
(CMH) survivent et gagnent la périphérie sous la forme de LyT
matures naïfs. La sélection négative élimine quant à elle les
précurseurs de LyT fortement autoréactifs.
La sélection négative a longtemps été considérée comme le
principal mécanisme de tolérance au soi. Toutefois, il est
désormais clair que ce processus n’est que partiel et que des
LyT autoréactifs sont produits de façon physiologique [1],
rendant indispensables des mécanismes de tolérance péri-
phérique. Les mécanismes périphériques d’immunorégula-
tion sont multiples. Ils comprennent notamment la mort cellu-
laire induite par l’activation, la modulation de la mise en jeu
des molécules de costimulation et des récepteurs inhibiteurs,
et la différentiation des LyT vers des populations produisant
des profils cytokiniques différents et se régulant mutuellement
(balance Th1/Th2). Les mécanismes régulateurs dépendants
de cellules T suppressives constituent quant à eux un proces-
sus actif par lequel une population de cellules contrôle
l’activation d’une autre. Le concept que des LyT suppresseurs
contrôlent les réponses immunitaires repose sur des expérien-
ces déjà anciennes d’induction de tolérance par transfert
adoptif de LyT provenant d’un animal tolérisé [2]. On savait
également que la thymectomie pratiquée sur des souris de
trois jours (mais non chez des souris plus âgées) provoquait
des manifestations autoimmunes spécifiques d’organe [3],
qui pouvaient être prévenues par l’injection de LyT de souris
adultes mais pas de souris également thymectomisées à J3
[4]. Ceci suggérait donc l’existence des cellules régulatrices
produites à partir de J3 chez la souris. Depuis lors, le
développement progressif de marqueurs de surface dissé-
quant l’hétérogénéité phénotypique et fonctionnelle des LyT
[5] a permis l’identification précise de sous-populations de
LyT effecteurs et, plus récemment, de sous-populations sup-
pressives. C’est en effet l’absence de caractérisation molécu-
laire précise qui a, pendant longtemps, rendu ce domaine
difficile. Si l’existence de la suppression était étayée par de
nombreuses évidences scientifiques, la nature des cellules
suppressives restait mystérieuse alors que les modèles théori-
ques se complexifiaient avec l’intervention de lymphocytes
effecteurs-suppresseurs et suppresseurs-inducteurs, la produc-
tion de facteurs suppresseurs solubles spécifiques d’antigè-
nes et un déterminisme génétique impliquant une possible
région I-J localisée entre les régions I-A et I-E du CMH de
classe II murin [6]. L’impossibilité de définir au plan molécu-
laire la nature précise de ces facteurs suppresseurs mais aussi
la découverte par analyse moléculaire que la région I-J
n’existait pas physiquement [7] a conduit la communauté des
immunologistes à se désintéresser brutalement de cette ques-
tion, allant jusqu’à bannir le mot “suppresseur” du champ
lexical de cette discipline et quasiment interdire tout accès
éditorial aux travaux dans ce domaine pendant plusieurs
années. Toutefois, grâce à une meilleure définition molécu-
laire, les années récentes ont vu la spectaculaire
ré-émergence de cette thématique qui est redevenue un des
champs les plus actifs de recherche en immunophysiologie et
immunopathologie.
Plusieurs sous-populations lymphocytaires T régulatrices,
intervenant à différentes étapes de la réponse immunitaire,
ont été caractérisées, parmi lesquelles les LyT naturels
CD4
+
CD25
+
, les LyT induits Th3 (sécréteurs de TGFb), les LyT
induits Tr1 (sécréteurs d’interleukine-10 et de TGFb), certains
LyT CD8
+
et les lymphocytes NK-T. Nous décrirons ici les
principales caractéristiques des LyT CD4
+
CD25
+
régulateurs
(Treg) et leur rôle chez l’homme dans certaines pathologies.
Mise en évidence des Treg
chez la souris
Les travaux de Sakaguchi et al. ont été déterminants dans la
caractérisation des Treg CD4
+
CD25
+
. Ils ont montré que le
transfert à des souris lymphopéniques, de LyT déplétés en LyT
CD4
+
CD25
+
conduisait en quelques semaines à l’émer-
gence de nombreuses manifestations autoimmunes touchant
la thyroïde, l’estomac, les ilôts bdu pancréas, les glandes
salivaires et surrénales, les ovaires, les reins et les articula-
tions [8]. L’administration de LyT CD4
+
CD25
+
dans les jours
qui suivent celle des LyT CD4
+
CD25
-
, prévenait la survenue
de ces manifestations. Ces observations spectaculaires impo-
sent plusieurs conclusions. Tout d’abord, elles confirment que
la sélection négative des LyT autoréactifs dans le thymus n’est
que partielle et que le système immunitaire normal contient
des LyT autoréactifs susceptibles d’entraîner “spontanément”
des maladies autoimmunes en l’absence de toute immunisa-
tion expérimentale par des autoantigènes. Deuxièmement,
elles montrent que ces LyT autoréactifs produits physiologi-
quement sont placés sous le contrôle permanent d’une sup-
pression dominante exercée par des Treg de phénotype
CD4
+
CD25
+
. Enfin, elle ouvre des perspectives d’immuno-
régulation thérapeutique par les Treg.
Ces résultats sont à rapprocher de ceux obtenus dans un
modèle de souris transgéniques pour un TCR dirigé contre la
protéine basique de la myéline. De façon surprenante, seule
une minorité de ces souris - dont le répertoire des LyT est
pourtant massivement (mais, du fait de réarrangements endo-
gènes du TCR, non exclusivement) dirigé contre un auto-
antigène du système nerveux central - développait une
encéphalite. En revanche, lorsque ces souris étaient croisées
sur un fond RAG-déficient (un modèle empêchant les réarran-
gements du TCR et garantissant ainsi un répertoire 100 %
autoréactif transgénique), alors la totalité des animaux déve-
loppait une encéphalite autoimmune.
On comprend donc que, dans ces conditions expérimentales,
la survenue d’une maladie autoimmune (ici, un modèle de
sclérose en plaque) dépend non seulement de la présence de
LyT autoréactifs mais aussi de l’absence de LyT exerçant une
Hématologie, vol. 12, n° 3, mai-juin 2006
165
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 25/05/2017.

fonction régulatrice. De nombreuses études qu’il n’est pas
possible de citer intégralement ici, ont maintenant démontré
avec certitude que les Treg CD4
+
CD25
+
préviennent de
façon physiologique l’activation des LyT autoréactifs et donc
la survenue de maladies autoimmunes.
Identification et propriétés des Treg
La définition des Treg sur la seule co-expression de CD4 et de
CD25 (chaîne adu récepteur de l’interleukine-2) demeure
peu précise. Ce dernier est en effet un marqueur peu spécifi-
que des Treg puisque les LyT conventionnels expriment transi-
toirement CD25 après activation. Aussi, si les Treg sont bien
des cellules CD4
+
CD25
+
, on ne saurait affirmer que toutes les
cellules CD4
+
CD25
+
(qui représentent 5-10 % des LyT CD4
+
d’une souris normale) sont des Treg. L’étude de souris défi-
cientes en IL-2 ou en CD25 (qui présentent un déficit de Treg
associé à une lymphoprolifération et des signes d’autoimmu-
nité) a montré que l’interleukine-2 est une cytokine essentielle
au développement des Treg et à leur fonction dans l’homéos-
tasie du système immunitaire [9].
Chez l’homme, l’existence des Treg CD4
+
CD25
+
est mainte-
nant bien établie [10-12]. Leur identification est toutefois
rendue difficile par le fait qu’une fraction importante (20-
40 %) des LyT CD4
+
exprime CD25 chez l’homme. Une
analyse plus détaillée du niveau d’expression du CD25
montre qu’il existe en fait, parmi les LyT CD4
+
CD25
+
, une
forte majorité de cellules exprimant des niveaux intermédiai-
res de CD25 (CD25
int
) et une population très minoritaire en
exprimant des niveaux très élevés (CD25
hi
), ces dernières ne
représentant environ que 0,8-1 % des LyT CD4
+
. Hafler et al.
ont montré que, chez un sujet sain, la population
CD4
+
CD25
int
n’est pas suppressive (elle contient notamment
un compartiment de LyT récemment activés) alors que les Treg
sont contenus dans la population CD4
+
CD25
hi
[13]. D’autres
marqueurs des Treg sont maintenant décrits mais aucun n’est
strictement spécifique des Treg (tableau 1).
Les Treg sont des cellules anergiques in vitro. En particulier,
leur activation via le TCR ne conduit pas à leur prolifération,
contrairement aux LyT CD4
+
CD25
-
conventionnels placés
dans les mêmes conditions expérimentales. Cette affirmation
doit toutefois être nuancée car l’anergie in vitro des Treg est
levée en présence d’interleukine-2. Cette propriété est impor-
tante car l’interleukine-2 permet de faire proliférer fortement
ces cellules in vitro, un point essentiel si l’on se place dans
une perspective d’utilisation thérapeutique des Treg qui
demeurent des cellules rares au sein du système immunitaire
et donc difficiles à obtenir en grand nombre.
Outre l’anergie réversible par l’interleukine-2, la deuxième
propriété fondamentale des Treg est évidemment leur capa-
cité suppressive. Celle-ci se mesure habituellement par un test
d’inhibition de la prolifération in vitro. Pour cela, on ajoute à
des LyT CD4
+
CD25
-
répondeurs, des doses croissantes de
Treg CD4
+
CD25
+
(jusqu’à un rapport 1:1), et l’on mesure
l’incorporation de thymidine sous activation par un mitogène
ou par un anticorps anti-CD3 immobilisé (+/- anti-CD28
soluble). Le rôle de cette activation est d’induire la proliféra-
tion des LyT répondeurs mais aussi d’activer les Treg. L’effet
suppresseur des Treg nécessite en effet une activation via leur
TCR et un contact cellulaire avec les cellules cibles de la
suppression. Fait important, si cet effet suppresseur des Treg
nécessite leur activation TCR-dépendante (et donc antigène-
dépendante), la suppression peut s’exercer sur des LyT dont
la spécificité antigénique est différente (suppression antigène-
indépendante). Au plan physiologique, ceci permet à un
répertoire limité de Treg reconnaissant seulement certains
autoantigènes d’un tissu donné, d’assurer dans ce tissu ou
dans les ganglions lymphatiques le drainant, une suppression
efficace des LyT autoréactifs de spécificité plus large.
Outre l’inhibition de la prolifération des LyT CD4
+
CD25
-
, les
Treg apparaissent capables d’exercer d’autres fonctions de
régulation négative comme l’inhibition de la production de
cytokines ou d’agir sur d’autres types cellulaires comme les
LyT CD8
+
, les cellules dendritiques, les LyB, les cellules NK...
Aussi, devant le résultat normal d’un test d’inhibition de la
prolifération des LyT CD4
+
CD25
-
, il convient d’être prudent
avant de conclure, dans une situation pathologique donnée,
à l’absence de déficit qualitatif des Treg puisque celui-ci peut
se manifester sur un autre aspect de la suppression. C’est le
cas par exemple de la polyarthrite rhumatoïde où l’inhibition
de la prolifération par les Treg est normale [14] mais où les
Treg s’avèrent limités dans leur capacité à contrôler efficace-
ment la production de TNFa[15]. Citons également le cas du
déficit qualitatif de Treg dans la sclérose en plaque où la
différence entre les patients et les témoins n’est visible qu’à
certains niveaux d’activation des cellules répondeuses [16].
On ne peut donc qu’insister sur l’importance des conditions
expérimentales dans ce type d’études.
Tableau 1
Principaux marqueurs phénotypiques des Treg chez l’homme
Marqueur Fonction
TCRab Reconnaissance de l’antigène
CD3 Transduction du signal
CD4 Corecepteur du TCR
CD25 Récepteur de l’interleukine-2 (chaîne a)
CD122 Récepteur de l’interleukine-2 (chaîne b)
CD62L Entrée dans le ganglion lymphatique
CD28 Costimulation
CD137 (4-1BB) Costimulation
GITR Costimulation
CD152 (CTLA-4) Costimulation (inhibition)
CD45RO+/CD45RA- Marqueurs de cellules mémoires
HLA-DR Marqueur d’activation
CD71 Marqueur d’activation
Neuropiline 1 Synapse immunologique
CD223 (LAG-3) Ligand du CMH de classe II
CD103 Migration dans les muqueuses
Foxp3 Facteur de transcription Treg-spécifique
Hématologie, vol. 12, n° 3, mai-juin 2006
166
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 25/05/2017.

Même s’il n’est pas exclu que des Treg puissent être produits
à la périphérie par différenciation de LyT CD4
+
CD25
-
,la
génération des Treg in vivo est essentiellement un processus
thymo-dépendant. Le fait de savoir si les Treg constituent un
lignage particulier de LyT soumis à une sélection positive
particulière ou s’ils émergent à la suite d’un processus altéré
de sélection négative demeure un point non élucidé à ce jour.
Il apparaît en effet que les Treg sont eux-mêmes des LyT
autoréactifs. Ceci est notamment illustré par le fait que le
thymus de souris transgéniques exprimant un TCR dirigé
contre l’hémagglutinine (HA) du virus influenza et croisées
avec une lignée exprimant HA (représentant ici un néo-
autoantigène) donne naissance à l’émergence d’un grand
nombre de Treg lorsque le TCR transgénique possède une
forte affinité pour HA, et non lorsque cette affinité est faible
[17]. Ce modèle élégant montre donc que l’interaction à
haute affinité d’un TCR avec son ligand dans le thymus
n’entraîne pas uniquement la sélection négative comme on le
concevait jusqu’alors, mais permet également la production
de Treg, eux-mêmes autoréactifs. Les interactions moléculai-
res permettant la sélection, la survie et la fonction des Treg
sont encore mal connues mais font très probablement interve-
nir des molécules de costimulation, par exemple le couple
CD28/CD80 dont l’invalidation génétique entraîne une forte
réduction du nombre de Treg et favorise la survenue de
manifestations autoimmunes comme le diabète de type 1
[18]. Ainsi, la contribution du thymus dans la tolérance
immunologique au soi, considéré jusqu’à une époque
récente comme essentiellement liée à la sélection négative
des LyT autoréactifs s’enrichit désormais d’une deuxième
fonction : la production de Treg exerçant une suppression
dominante sur les LyT autoréactifs ayant échappé à la sélec-
tion négative. Les propriétés générales des Treg sont résu-
mées dans le tableau 2.
Rôle de Foxp3
Un des faits les plus marquants dans la recherche sur les Treg
a été l’identification de Foxp3, un membre de la famille
forkhead, comme facteur de transcription essentiel à la
biologie de ces cellules [19]. Ainsi, des mutations de Foxp3
chez l’homme entraînent le syndrome IPEX (immune dysregu-
lation polyendocrinopathy enteropathy X-linked syndrome)
responsable d’une maladie lymphoproliférative et poly-
autoimmune mortelle [20, 21]. Il est intéressant de noter
qu’avant l’identification des Treg, Foxp3 avait été initiale-
ment considéré comme un facteur de régulation négative de
l’activité des LyT conventionnels [22]. Ainsi, des souris trans-
géniques (Tg) exprimant constitutivement Foxp3 apparais-
sent lymphopéniques et immunodéficientes [23]. À l’inverse,
les souris scurfy présentant une mutation de Foxp3 succom-
bent à l’âge de 3-4 semaines d’un syndrome lymphoprolifé-
ratif [24], comme cela a été reproduit plus tard par l’invalida-
tion du gène Foxp3 [25]. En utilisant des souris dont le gène
foxp3 endogène a été remplacé par un gène hybride codant
pour une protéine de fusion GFP-Foxp3, l’expression de ce
facteur a pu être visualisée in situ dans les différentes popula-
tions lymphocytaires [26]. Cette étude a montré que ce
facteur n’est exprimé que par5à10%deslymphocytes T
périphériques appartenant exclusivement au lignage a/b.Il
s’agit pour l’essentiel (80 %) de Treg CD4
+
CD25
+
, bien
qu’une minorité de cellules CD4
+
CD25
-
Foxp3
+
et
CD8
+
Foxp3
+
aient également été observées. Enfin, la trans-
duction par un vecteur rétroviral du gène Foxp3 permet de
convertir des LyT conventionnels en Treg fonctionnels capa-
bles d’exercer une activité suppressive in vitro et in vivo [19,
23, 25]. Dans une perspective clinique, les Treg étant une
sous-population rare et difficile à purifier du fait de l’absence
de marqueur de surface réellement spécifique, le transfert de
gène Foxp3 ouvre la voie à la production de Treg modifiés
génétiquement à des fins thérapeutiques. Il est probable que
le succès de cette approche sera fortement conditionné par le
niveau d’expression de Foxp3 transgénique, comme en
témoigne la difficulté actuelle à y parvenir chez l’homme
[27].
Treg et maladies autoimmunes
La détermination du rôle des Treg en pathologie constitue à
l’heure actuelle un champ de recherche intense. Du fait du
rôle des Treg dans la régulation négative des LyT autoréactifs
chez l’animal, l’attention s’est immédiatement portée sur la
recherche de déficits quantitatifs des Treg dans les maladies
autoimmunes (tableau 3). L’exemple le plus caricatural est
celui du syndrome IPEX dans lequel une mutation du gène
foxp3 conduit à l’absence de Treg et à la survenue d’un
tableau clinique complexe associant lymphoprolifération,
atteintes autoimmunes multiples, manifestations allergiques et
altération de l’état général conduisant au décès [20, 21]. À
ce jour, de nombreuses maladies autoimmunes acquises ont
également été associées à un déficit en Treg. Ainsi, une
diminution de la fréquence des Treg dans le sang a été
observée au cours des vascularites associées à l’infection par
le virus de l’hépatite C [28] ou des poussées de lupus
Tableau 2
Principales propriétés des Treg
Produits par le thymus
Auto-réactifs (reconnaissance de complexes CMH/peptide
du soi)
Répertoire diversifié de TCR
Anergique in vitro (en l’absence d’interleukine-2)
Pas de production d’interleukine-2 en réponse à l’activation
Inhibent la prolifération des LyT et la sécrétion de cytokines in
vitro
Action régulatrice sur les LyT, les monocytes, les cellules
dendritiques et les LyB
Régulent physiologiquement l’autoimmunité
Activation antigène-dépendante par le TCR requise pour la
suppression
Suppression non antigène-spécifique après activation par le TCR
Hématologie, vol. 12, n° 3, mai-juin 2006
167
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 25/05/2017.

érythémateux systémique [29]. Dans la sclérose en plaque, il
ne semble pas exister de déficit quantitatif mais plutôt un
déficit qualitatif, attesté par une diminution de la capacité des
Treg à inhiber la prolifération de LyT CD4
+
CD25
-
[16]. De
façon intéressante, les LyT CD4
+
CD25
-
des patients comme
des témoins demeurent sensibles à la suppression par les Treg
des témoins, suggérant que c’est bien un défaut des Treg et
non une résistance des LyT des patients à la suppression qui
est associée à cette maladie. Au cours de la polyarthrite
rhumatoïde, on n’observe pas de diminution significative du
nombre de Treg dans le sang mais une fréquence augmentée
de Treg fonctionnels dans le liquide synovial [14]. Une étude
plus approfondie a toutefois suggéré que, si la capacité des
Treg à inhiber la prolifération des LyT CD4
+
CD25
-
semble
conservée, il existerait un déficit de leur capacité à supprimer
la production par les LyT CD4
+
CD25
-
mais aussi par les
monocytes de TNFa, une cytokine au cœur du processus
physiopathologique de cette maladie [15]. De façon intéres-
sante, les auteurs ont observé une corrélation entre l’efficacité
clinique des anticorps anti-TNF (infliximab), l’augmentation
du nombre de Treg circulants après traitement et la restaura-
tion de la capacité suppressive des Treg vis-à-vis des cellules
productrices de TNF. Récemment, un effet inhibiteur direct du
TNF sur la fonction suppressive des Treg a été démontré [30].
Citons également la myasthénie, qui apparaît associée à une
perte de l’anergie des LyT CD4
+
CD25
+
et à une diminution
de l’activité suppressive des Treg, associées à une baisse du
niveau d’expression des messagers de Foxp3 par les LyT
CD4
+
CD25
+
[31]. On rapprochera de ces observations
dans le domaine de l’autoimmunité, un rôle probable des
Treg au cours des maladies allergiques [32] ou dans la
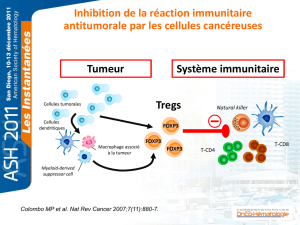
pathologie tumorale [33] dont la description dépasse le
cadre de cette revue. Bien que des études complémentaires
demeurent nécessaires pour confirmer ces observations, les
Treg ont désormais pris une place centrale dans la physiopa-
thologie des maladies autoimmunes. Une meilleure compré-
hension des mécanismes moléculaires impliqués dans la
fonction suppressive des Treg ainsi que l’identification des
facteurs génétiques qui contrôlent la différenciation et la
fonction des Treg apporteront certainement des éléments
décisifs dans la compréhension des maladies autoimmunes et
pourraient également permettre de définir de nouvelles cibles
thérapeutiques.
Un rôle pour les Treg dans le champ
de la greffe de moelle ?
Si le champ de prédilection des études sur l’immunophysiolo-
gie et l’immunopathologie des Treg est celui de l’autoimmu-
nité, les effets suppresseurs non spécifiques des Treg sur
différentes populations cellulaires, autoréactives ou non,
ouvrent les perspectives d’une manipulation de ces cellules
dans le domaine de la transplantation d’organe ou de la
greffe de cellules souches hématopoïétiques (CSH). Il a par
exemple été montré que le transfert de LyT CD25
+
provenant
d’une souris chez laquelle on a induit une tolérance à une
greffe de peau allogénique, permet de transférer cet état de
tolérance à une souris receveuse et que la tolérance ainsi
acquise est spécifique des alloantigènes tolérogènes [34].
Des résultats similaires ont été obtenus dans un modèle
d’induction de tolérance à une allogreffe d’îlots pancréati-
ques, également transférable par les LyT CD25
+
[35]. On
peut rapprocher ces observations du rôle des Treg dans la
tolérance materno-fœtale qui implique également la régula-
tion d’une réponse alloréactive, dirigée dans ce cas contre
les alloantigènes paternels [36, 37]. Il pourrait donc exister,
au sein du répertoire polyclonal des LyT CD4
+
CD25
+
, des
Treg susceptibles de s’activer après reconnaissance d’alloan-
tigènes et d’exercer des effets suppresseurs dont nous avons
vu qu’ils n’étaient pas spécifiques d’antigène et pourraient
donc avoir un large spectre d’action, y compris sur des LyT
alloréactifs. Ceci peut paraître paradoxal puisque les Treg
sont considérés comme des cellules essentiellement autoréac-
tives. Toutefois, la fréquence des LyT alloréactifs au sein d’une
population de LyT étant élevée (5-10 %), il est probable que
des cellules alloréactives existent de façon similaire au sein
des Treg.
La première démonstration d’un rôle des Treg dans le
contrôle des LyT alloréactifs en situation de greffe de moelle a
consisté à montrer que la déplétion préalable des Treg induit
une accélération de la GVH après co-transfert de CSH et de
LyT chez des receveurs allogéniques irradiés [38]. Ce résultat
indique que les Treg exercent au sein du greffon un certain
degré d’activité suppressive. Fait essentiel, l’enrichissement
du greffon en Treg du donneur entraîne une amélioration de
Tableau 3
Exemples d’implication des Treg en pathologie
Pathologie Nature du déficit ou rôle des
Treg
IPEX mutation de Foxp3, absence de Treg,
lymphoprolifération, atteintes
autoimmunes multiples, maladie
mortelle
Vascularite VHC
+
déficit quantitatif
Lupus déficit quantitatif lors des poussées
Polyarthrite rhumatoïde moindre effet suppresseur de la
production de TNFa
sous anti-TNF, nombre de Treg corrélé
à la réponse clinique
Sclérose en plaque déficit qualitatif (diminution de la
suppression)
Myasthénie déficit qualitatif, baisse d’expression
de Foxp3
Allergie moindre suppression des réponses Th2
Immunité anti-parasitaire Treg empêchent l’élimination complète
du parasite mais permettent le maintien
de la mémoire immunologique
Cancer diminution de l’immunité antitumorale,
mauvais pronostic si nombre de Treg
élevé
GVH Treg limitent l’alloréactivité des greffons
Hématologie, vol. 12, n° 3, mai-juin 2006
168
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 25/05/2017.
 6
6
 7
7
1
/
7
100%