laboratoire - génie génétique - Collège Lionel

Collège Lionel-Groulx Évolution et diversité du vivant 101-NYA-05
1
LABORATOIRE - GÉNIE GÉNÉTIQUE
Transformation bactérienne et
résistance aux antibiotiques
1 OBJECTIFS
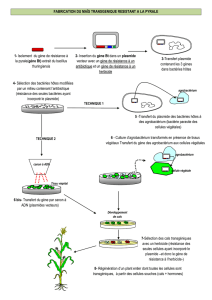
1. Effectuer une transformation génétique sur la bactérie Escherichia coli (E. coli) en insérant un gène de résistance
à un antibiotique et vérifier si la résistance obtenue est spécifique ou étendue à plusieurs antibiotiques.
2. Utiliser comme vecteur de transformation un plasmide porteur d’un gène de contrôle, le gène de fluorescence
de la méduse Aequorea victoria (A. victoria).
3. Appliquer des techniques d’asepsie, de culture de microorganismes et de transfert de microvolumes.
4. Réaliser une expérimentation contrôlée au moyen de groupes témoins.
5. Réaliser un travail pratique illustrant l’effet des antibiotiques, la résistance bactérienne et la régulation de
l’expression des gènes par des facteurs de l’environnement.
2 SÉCURITÉ AU LABORATOIRE
Bactéries et ADN: éviter de se contaminer ou de contaminer des objets ou le laboratoire.
En cas de doute, nettoyer soigneusement.
Surveiller les becs de gaz. Ajuster le brûleur avec soin. Attacher les cheveux.
Les UV affectent la peau et les yeux. Utiliser du verre protecteur.
Comme toujours :
◦ Port du sarrau obligatoire.
◦ Nettoyer le plan de travail et les mains avant et après le laboratoire.
◦ Il est interdit de manger ou de boire au laboratoire.
3 PRÉPARATION AU LABORATOIRE
Séance 1. Lire le document et compléter l’Annexe (page 11) 1 à l’aide de la section «Protocole expérimental» (pages
6-8).
Séance 2. Formuler une hypothèse et complétez le tableau des résultats attendus à l’Annexe 2 (page 12).

2
4 INTRODUCTION
4.1 GÉNIE ET CODE GÉNÉTIQUE
En génie génétique, on utilise des outils moléculaires pour étudier et manipuler l’ADN à des fins
pratiques : thérapies anti-cancer, agriculture (OGM), pharmacologie (insuline pour les diabétiques
produites par des bactéries) [1, p. 459]. Parmi les premières manipulations génétiques, en 1972
le chercheur Stanley Cohen introduit un gène de résistance à l'antibiotique tétracycline dans des
bactéries E. coli [2].
Un code universel. En 2001, l’ADN humain a été complètement décodé [3] et contient environ 3
milliards de nucléotides (A, T, C et G) alignés en de longues séquences qui constituent les gènes.
Le code génétique serait apparu il y a 3 à 4 milliards d’années chez des bactéries, les ancêtres des
organismes actuels. Il serait quasi universel : un gène d’une espèce peut être transplanté et
décodé par une autre espèce; par exemple, un plant de tabac peut s’illuminer après avoir reçu un
gène de luciole (figure 1) [1, p. 383, 4]!
Au cours de ce laboratoire, nous introduirons des gènes dans la bactérie E. coli à l’aide d’un plasmide bactérien. Voici les 2
principaux gènes transférés:
un gène de résistance à l’antibiotique ampicilline; nous vérifierons si la résistance acquise est spécifique à cet
antibiotique ou si la résistance acquise permet la survie face à divers antibiotiques;
un gène de contrôle, emprunté à une méduse, qui rend vert-fluorescent sous UV; il permettra de s’assurer que la
résistance acquise provient bien de gènes transférés par le plasmide et non d’une autre source.
4.2 BACTÉRIES MULTIRÉSISTANTES
Santé publique menacée. En 1929, Alexander Flemming découvre que la moisissure Penicillium notatum produit une substance
(la «pénicilline») capable de tuer certaines bactéries [1, p. 756]. Par la suite, des centaines d’autres «antibiotiques» ont été
identifiés et ont contribué à sauver un nombre incalculable de vies humaines et animales. Cependant, leur utilisation abusive
a contribué à l’augmentation de la résistance bactérienne; des bactéries multirésistantes constituent aujourd’hui une menace
très sérieuse à la santé publique, particulièrement en milieu hospitalier où le combat est devenu très ardu contre les
staphylocoques [1, p. 532] et autres Clostridium difficile (C. difficile) ou Neisseria gonorrhoeae (N. gonorrheae) [5, 6]
Évolution de la résistance. Lorsqu’une population de bactéries est exposée à un antibiotique (ex : dans le corps d’un malade,
dans un élevage porcin, etc.), les bactéries sensibles meurent mais il suffit de quelques bactéries plus résistantes qui survivent
et se multiplient pour créer une nouvelle population de bactéries résistantes; c’est un processus de sélection naturelle [1, p.
534].
Action des antibiotiques. Les antibiotiques agissent principalement sur la paroi bactérienne (ex : pénicilline et ampicilline) [1,
p. 644] ou sur la fabrication des protéines (ex : kanamycine) [7], mais il existe plusieurs autres modes d’action [8].
Acquisition et modes de résistance. Comment une bactérie donnée peut-elle devenir résistante? Une simple mutation dans
l’ADN bactérien peut modifier une des cibles de l’antibiotique qui est alors neutralisé. Mais le plus souvent, elle acquiert un
nouveau gène d’une bactérie déjà résistante; on parle alors de recombinaison génétique [1, p. 649]. Il existe plusieurs types
de gènes de résistance et ils peuvent être transférés de diverses manières. Par exemple, des bactéries résistantes possèdent
un gène codant pour un enzyme qui détruit l’antibiotique [1, p. 650]. Ces gènes spéciaux ont été élaborés au cours de
l’évolution des bactéries. Souvent, ils ne font pas partie de leur chromosome, ils sont plutôt inclus dans de petits anneaux
d’ADN appelés «plasmides» que seules certaines bactéries possèdent. Et ces plasmides peuvent être copiés et transmis à
d’autres bactéries!
FIGURE 1 – PLANT DE TABAC
LUMINEUX [4]

3
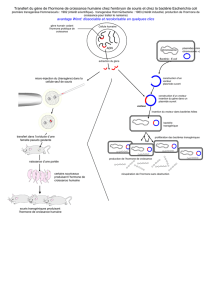
Transmission via les plasmides. Un plasmide est minuscule par rapport aux bactéries, environ 116,000 fois plus petit si on
compare E. coli et le plasmide pGLO! Une même bactérie peut donc posséder plusieurs plasmides. Les plasmides peuvent être
transférés de diverses façons. Le mécanisme le plus simple est appelé une «transformation» [1, p. 649]. Lorsqu’une bactérie
meurt, l’ADN libéré peut être absorbé par une autre bactérie qui devient ainsi «transformée». Ce mécanisme a vite été
récupéré par le génie génétique pour introduire des gènes étrangers. Il suffit d’isoler un gène d’intérêt, de l’insérer dans un
plasmide bactérien qui sert alors de «vecteur» et de le placer en présence de la bactérie à transformer [1, p. 460; fig. 20.2]!
Simple comme bonjour, ou presque.
4.3 LE PLASMIDE «PGLO», UN OUTIL BRILLANT
Divers plasmides sont maintenant disponibles sur le marché. Le plasmide «pGLO» (figure 2) contient quelques gènes dont trois
sont d’intérêt pour ce labo:
un gène de résistance Ampr codant pour l’enzyme β-lactamase qui détruit
l’ampicilline [7], un antibiotique dérivé de la pénicilline;
un gène de contrôle GFP emprunté à la méduse Aequorea victoria codant pour une
protéine fluorescente; il permet de vérifier visuellement que le plasmide a bien été
introduit dans la bactérie;
un 2e gène de contrôle AraC. En absence d’arabinose dans le milieu de croissance, le
gène GFP n’est pas transcrit (figure 3) tandis qu’en présence de la molécule
arabinose dans le milieu de croissance, il déclenche l’expression du gène GFP (figure
4). Ce type de gène s’appelle un «promoteur»; il contribue dans notre expérience à
vérifier l’introduction du plasmide dans la bactérie.
FIGURE 2 - PLASMIDE PGLO
FIGURE 3- EXPRESSION GÉNIQUE SANS LA PRÉSENCE D’ARABINOSE
DANS LE MILIEU DE CROISSANCE. « RNA POL » DÉSIGNE
L’ENZYME ARN POLYMÉRASE.
FIGURE 4- EXPRESSION GÉNIQUE AVEC LA PRÉSENCE D’ARABINOSE
DANS LE MILIEU DE CROISSANCE. « RNA POL » DÉSIGNE
L’ENZYME ARN POLYMÉRASE.
1
/
3
100%