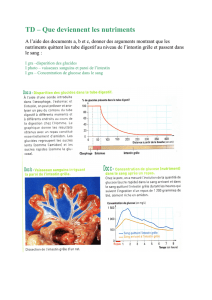
Modélisation clinique et biochimique de l`insuffisance intestinale

Mod´elisation clinique et biochimique de l’insuffisance
intestinale chronique chez l’homme. La concentration
plasmatique veineuse post-absorptive de citrulline,
marqueur de la masse ent´erocytaire absorptive
Pascal Crenn
To cite this version:
Pascal Crenn. Mod´elisation clinique et biochimique de l’insuffisance intestinale chronique chez
l’homme. La concentration plasmatique veineuse post-absorptive de citrulline, marqueur de la
masse ent´erocytaire absorptive. Sciences du Vivant [q-bio]. Universit´e Paris-Diderot - Paris
VII, 2000. Fran¸cais. <tel-00924295>
HAL Id: tel-00924295
https://tel.archives-ouvertes.fr/tel-00924295
Submitted on 6 Jan 2014
HAL is a multi-disciplinary open access
archive for the deposit and dissemination of sci-
entific research documents, whether they are pub-
lished or not. The documents may come from
teaching and research institutions in France or
abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est
destin´ee au d´epˆot et `a la diffusion de documents
scientifiques de niveau recherche, publi´es ou non,
´emanant des ´etablissements d’enseignement et de
recherche fran¸cais ou ´etrangers, des laboratoires
publics ou priv´es.


Université Paris 7-Denis Diderot
UFR Biologie et Sciences de la Nature
THESE de DOCTORAT de l'UNIVERSITE PARIS 7
Physiologie et Physiopathologie
de la Nutrition Humaine
Directeur de la formation doctorale : Pr. B Portha
Modélisation clinique et biochimique de l’insuffisance
intestinale chronique chez l’homme.
La concentration plasmatique veineuse post-absorptive de
citrulline, marqueur de la masse entérocytaire absorptive
.
par
Pascal CRENN
Présentée et soutenue publiquement le 9 novembre 2000
JURY :
Président : Pr. C RICOUR
Rapporteurs :
Pr. JF DESJEUX
Dr PH DUEE
Examinateurs :
Dr P DECHELOTTE
Pr. X LEVERVE
Directeur de thèse : Pr. B MESSING

2
Résumé : Modélisation clinique et biochimique de l’insuffisance intestinale chronique
chez l’homme. La concentration plasmatique veineuse post-absorptive de citrulline,
marqueur de la masse entérocytaire absorptive.
L’insuffisance intestinale chronique résulte le plus souvent d’une malabsorption nécessitant
une nutrition parentérale pour maintenir l'équilibre nutritionnel. Sa cause habituelle est le
syndrome de grêle court (SGC). Dans ce dernier (n=124) nous avons déterminé par analyse
actuarielle multidimensionnelle les facteurs de dépendance à la nutrition parentérale et de
survie. Nous avons ainsi discriminé l’insuffisance intestinale transitoire et permanente par les
césures de longueur de grêle selon le type anatomique et de période adaptative post-résection
(2 ans). Notre objectif a ensuite été de déterminer, dans l'insuffisance intestinale, un marqueur
biologique de la masse entérocytaire absorptive. Après avoir optimisé chez l’homme sain
l’administration digestive des traceurs isotopiques du métabolisme protéique (leucine,
glutamine) en démontrant que seule la perfusion duodénale, par rapport à la perfusion
gastrique, permettait d’obtenir des résultats reproductibles pour l'état stationnaire et
l’extraction splanchnique, nous avons fait l’hypothèse que la citrullinémie, acide aminé non
protéique produit du métabolisme entérocytaire de la glutamine, pouvait être un marqueur
candidat. En préalable, dans le SGC, nous avons validé une méthode radiologique pour
évaluer anatomiquement la masse intestinale et modélisé la masse intestinale fonctionnelle
grâce aux bilans d’absorption. Nous avons montré que l’hyperphagie était l’un des facteurs
majeurs qui caractérisait ces patients (présente chez 82%) et qu’elle participait à l’expression
de l’adaptation intestinale. Nous avons alors, dans le SGC (n=57), pu démontrer que la
citrullinémie est un marqueur de la masse entérocytaire du fait : a) de son abaissement par
rapport aux contrôles, b) de sa corrélation positive (r=0.83, P<0.0001) avec la longueur de
grêle, c) de sa liaison avec les coefficients d’absorption, d) de son pouvoir discriminant pour
le type et la sévérité de l'insuffisance intestinale. Nous avons confirmé notre hypothèse en
montrant dans un 2
ème
type d’insuffisance intestinale potentielle, le syndrome d’atrophie
villositaire (n=52 dont 42 maladies cœliaques), que la citrullinémie indiquait l’intensité et
l’étendue des lésions sur l’intestin grêle. Par contre dans la pseudo-obstruction intestinale
chronique (n=6), la citrullinémie est (sauf en cas de lésions histologiques intestinales)
subnormale. Nous avons vérifié que la dénutrition pure (marasme par anorexie mentale
restrictive, n=57) n’influençait pas la citrullinémie. L’évolution et la normalisation de la
citrullinémie après transplantation intestinale pour insuffisance intestinale permanente nous a
confirmé que, in vivo chez l’homme, la citrullinémie est bien d’origine grêlique. Ainsi la
citrullinémie veineuse post-absorptive peut être utilisée comme marqueur de la masse
entérocytaire absorptive.
Discipline : Physiologie et Physiopathologie de la Nutrition Humaine
Mots-clés : citrulline, insuffisance intestinale, nutrition parentérale, syndrome de grêle court,
atrophie villositaire, absorption intestinale, transit baryté du grêle, traceurs isotopiques,
transplantation intestinale.

3
Remerciements
Cette thèse n’aurait pu voir le jour sans la contribution de nombreuses personnes et
organismes que je tiens à citer ici :
Le professeur Bernard Messing, qui nous a guidé dans nos travaux, et dont l’exigence n’a
d’égard que le niveau élevé de compétence
Le docteur François Thuillier, pour son soutien
Le docteur Dominique Darmaun, pour ses judicieux conseils
Madame Marie-Christine Morin, pour sa grande expérience dans le recueil et l’analyse des
enquêtes diététiques
Le professeur Luc Cynober et le docteur Colette Coudray-Lucas, pour leur expertise dans
l’analyse des acides aminés plasmatiques
Le professeur Claude Matuchansky, pour sa rigueur et sa grande culture dans le domaine des
pathologies intestinales
Le docteur Marie-Christine Boutron, pour ses précieux conseils concernant l’analyse
statistique
Le professeur Michel Mignon, pour m’avoir reçu dans son service d’Hépato-
Gastroentérologie et Nutrition de l’hôpital Bichat, ce qui m’a permis de compléter ma
formation
Le professeur Daniel Rigaud, pour m’avoir initié dans certains domaines physiologiques et
fait entrevoir la complexité des troubles du comportement alimentaire
M. J. Arsham pour son importante contribution à la syntaxe anglo-saxonne
L’unité INSERM U290 (Hôpital Saint-Lazare, Paris), où une partie de ce travail a eut lieu
L’ESPEN (European Society of Enteral and Parenteral Nutrition Society), pour son soutien
matériel (ESPEN-Fellowship 1995) à la réalisation d’une partie des travaux présentés dans
cette thèse
L’ensemble des malades en situation d’insuffisance intestinale ayant participé aux travaux
présentés, ainsi que leurs soignants, en sachant combien le vécu et la prise en charge
quotidienne de cette situation est difficile
Et bien d’autres qui, peu ou prou, à travers notamment de nombreux échanges, ont également
contribué à l’élaboration de ce travail.
Je m'en voudrais enfin de ne pas citer Camille, qui a du endurer les mois de préparation de ce
manuscript.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
 58
58
 59
59
 60
60
 61
61
 62
62
 63
63
 64
64
 65
65
 66
66
 67
67
 68
68
 69
69
 70
70
 71
71
 72
72
 73
73
 74
74
 75
75
 76
76
 77
77
 78
78
 79
79
 80
80
 81
81
 82
82
 83
83
 84
84
 85
85
 86
86
 87
87
 88
88
 89
89
 90
90
 91
91
 92
92
 93
93
 94
94
 95
95
 96
96
 97
97
 98
98
 99
99
 100
100
 101
101
 102
102
 103
103
 104
104
 105
105
 106
106
 107
107
 108
108
 109
109
 110
110
 111
111
 112
112
 113
113
 114
114
 115
115
 116
116
 117
117
 118
118
 119
119
 120
120
 121
121
 122
122
 123
123
 124
124
 125
125
 126
126
 127
127
 128
128
 129
129
 130
130
 131
131
 132
132
 133
133
 134
134
 135
135
 136
136
 137
137
 138
138
 139
139
 140
140
 141
141
 142
142
 143
143
 144
144
 145
145
 146
146
 147
147
 148
148
 149
149
 150
150
 151
151
 152
152
 153
153
 154
154
 155
155
 156
156
 157
157
 158
158
 159
159
 160
160
 161
161
 162
162
 163
163
 164
164
 165
165
 166
166
 167
167
 168
168
 169
169
1
/
169
100%