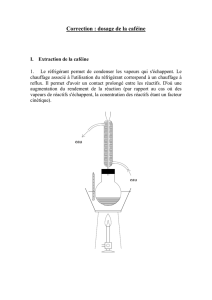
Peyona, INN-caffeine citrate

ANNEXE I
RÉSUMÉ DES CARACTÉRISTIQUES DU PRODUIT
1

1. DÉNOMINATION DU MÉDICAMENT
Peyona 20 mg/ml solution pour perfusion et buvable
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
1 ml de solution contient 20 mg de citrate de caféine (équivalant à 10 mg de caféine).
Une ampoule de 1 ml contient 20 mg de citrate de caféine (équivalant à 10 mg de caféine).
Une ampoule de 3 ml contient 60 mg de citrate de caféine (équivalant à 30 mg de caféine).
Pour la liste complète des excipients, voir rubrique 6.1.
3. FORME PHARMACEUTIQUE
Solution pour perfusion.
Solution buvable.
Solution aqueuse, claire et incolore, à pH = 4,7.
4. DONNÉES CLINIQUES
4.1 Indications thérapeutiques
Traitement de l’apnée primaire du nouveau-né prématuré.
4.2 Posologie et mode d’administration
Le traitement par le citrate de caféine devra être instauré sous la surveillance d’un médecin spécialisé
en soins intensifs néonatals. Le traitement ne devra être administré que dans une unité de soins
intensifs néonatals disposant du matériel adapté pour la surveillance et le contrôle des patients.
Posologie
Le schéma posologique recommandé chez les enfants n’ayant pas été précédemment traités est une
dose de charge de citrate de caféine de 20 mg par kg de poids corporel administrée en perfusion
intraveineuse lente de 30 minutes, au moyen d’une pompe et seringue pour perfusion ou d’un autre
dispositif de perfusion avec doseur.
Après 24 heures, des doses d’entretien de 5 mg par kg de poids corporel peuvent être administrées en
perfusion intraveineuse lente de 10 minutes toutes les 24 heures.
Il est également possible d’administrer toutes les 24 heures des doses d’entretien de 5 mg par kg de
poids corporel par voie orale, par ex. au moyen d’une sonde nasogastrique.
Les doses de charge de citrate de caféine et les doses d’entretien recommandées sont indiquées dans le
tableau suivant ainsi que les volumes injectés correspondant aux doses administrées exprimées en
citrate de caféine.
La dose exprimée en caféine base correspond à la moitié de la dose exprimée en citrate de caféine
(20 mg de citrate de caféine équivalent à 10 mg de caféine base).
Dose de citrate de
caféine (volume)
Dose de citrate de
caféine (mg/kg de
poids corporel)
Voie d’administration
Fréquence
Dose de
charge
1,0 ml/kg de poids
corporel
20 mg/kg de poids
corporel
Perfusion intraveineuse
(de 30 minutes)
Une fois
Dose
d’entretien*
0,25 ml/kg de
poids corporel
5 mg/kg de poids
corporel
Perfusion intraveineuse
(de 10 minutes) ou
Toutes les 24
heures*
2

administration par voie
orale
* En débutant 24 heures après la dose de charge
Chez les nouveau-nés prématurés présentant une réponse clinique insuffisante après la dose de charge
recommandée, il est possible d’administrer, 24 heures plus tard, une seconde dose de charge de 10 à
20 mg/kg maximum.
Des doses d'entretien supérieures soit 10 mg/kg de poids corporel pourront être envisagées en cas de
réponse insuffisante ; il faudra alors tenir compte de la possibilité d'accumulation de la caféine liée à
sa longue demi-vie chez les nouveau-nés prématurés et du fait que la capacité à métaboliser la caféine
augmente progressivement avec l’âge post-menstruel (voir rubrique 5.2). En cas de nécessité clinique,
les concentrations plasmatiques de caféine devront être surveillées. Il pourra être nécessaire de
reconsidérer le diagnostic d'apnée du prématuré en cas de réponse inadaptée du patient à une seconde
dose de charge ou à une dose d'entretien de 10 mg/kg/jour (voir rubrique 4.4.).
Ajustements posologiques et surveillance
Il pourra être nécessaire de surveiller les taux plasmatiques de caféine périodiquement au cours du
traitement en cas de réponse clinique insuffisante ou de survenue de signes de toxicité.
De plus, il pourra être nécessaire d’ajuster la posologie, après avis médical, en cas de surveillance
systématique des concentrations plasmatiques de caféine dans des situations à risque telles que :
− très grands prématurés (nés avant 28 semaines de gestation et/ou poids corporel < 1000 g)
notamment en cas alimentation parentérale
− nouveau-nés souffrant d’insuffisance hépatique ou rénale (voir rubrique 4.4 et 5.2)
− nouveau-nés souffrant de troubles épileptiques
− nouveau-nés présentant une cardiopathie connue avec manifestations cliniques
− nouveau-nés traités simultanément par des médicaments modifiant le métabolisme de la caféine
(voir rubrique 4.5)
− nouveau-nés allaités par des mères consommant de la caféine.
Il est recommandé de mesurer les concentrations initiales de caféine chez :
− les nouveau-nés dont la mère a pu consommer de grandes quantités de caféine avant
l’accouchement (voir rubrique 4.4)
− les nouveau-nés ayant reçu précédemment de la théophylline métabolisée en caféine.
La demi-vie de la caféine est prolongée chez les prématurés. Il existe donc un risque d’accumulation,
pouvant nécessiter une surveillance des enfants traités pendant une période prolongée (voir rubrique
5.2).
Dans le cadre de cette surveillance, les prélèvements sanguins devront être effectués juste avant la
dose suivante en cas d’échec thérapeutique et 2 à 4 heures après la dernière dose en cas de suspicion
de toxicité.
Aucune marge thérapeutique de caféinémie n’a pu être déterminée dans la littérature ; cependant des
études ont montré un bénéfice clinique pour des caféinémies comprises entre 8 et 30 mg/l et ; de plus,
aucun problème de sécurité d’emploi n’a été observé pour des taux plasmatiques inférieurs à 50 mg/l.
Durée du traitement
La durée optimale du traitement n’a pas été établie. Dans une grande étude multicentrique récente chez
des nouveau-nés prématurés, une durée moyenne de 37 jours de traitement a été rapportée.
En pratique clinique, le traitement est généralement poursuivi jusqu’à ce que le nouveau-né ait atteint
l’âge gestationnel de 37 semaines d’aménorrhée ; en général, l’apnée du nouveau-né prématuré
disparait alors spontanément. Cependant, la durée du traitement pourra être revue individuellement,
selon le jugement clinique et en fonction de la réponse au traitement, de la persistance d’épisodes
d’apnée malgré le traitement ou d’autres éléments cliniques. Il est recommandé d’arrêter
l’administration du citrate de caféine après une période de 5 ou 7 jours sans épisode d’apnée
significatif.
3

En cas de récidive d’apnée le traitement par le citrate de caféine peut être repris soit à une dose
d’entretien, soit à la moitié de la dose de charge, cela dépend de l’intervalle de temps écoulé entre
l’arrêt du citrate de caféine et la récidive de l’apnée.
Compte tenu de la lente élimination de la caféine dans cette population de patients, il n’est pas
nécessaire de diminuer progressivement la dose à l’arrêt du traitement.
Il convient de continuer à surveiller le patient pendant encore environ une semaine en raison du risque
de récidive des épisodes d’apnée après l’arrêt du traitement par le citrate de caféine.
Insuffisance hépatique et rénale
Seule une expérience limitée est disponible chez les patients présentant une insuffisance rénale et
hépatique. Dans une étude de sécurité post-autorisation, la fréquence des effets indésirables chez un
petit nombre de grands prématurés présentant une insuffisance rénale ou hépatique a semblé être
supérieure à celle des prématurés ne souffrant pas de l’insuffisance d’un organe (voir rubriques 4.4 et
4.8).
En présence d’une insuffisance rénale, il existe un risque accru d’accumulation. La dose d’entretien
journalière de citrate de caféine devra être réduite. Cette dose devra être déterminée en se basant sur
les taux plasmatiques de caféine mesurés.
Chez les très grands prématurés, la clairance de la caféine ne dépend pas de la fonction hépatique. Le
métabolisme hépatique de la caféine augmente progressivement dans les semaines qui suivent la
naissance et, chez les nouveau-nés les plus âgés, une maladie hépatique peut nécessiter une
surveillance des taux plasmatiques de caféine et ainsi que des adaptations posologiques (voir rubriques
4.4 et 5.2).
Mode d’administration
Le citrate de caféine peut être administré par perfusion intraveineuse et par voie orale. Ce médicament
ne doit pas être administré par voie intramusculaire, sous-cutanée, intrathécale ou intrapéritonéale.
Par voie intraveineuse, le citrate de caféine devra être administré par perfusion intraveineuse contrôlée,
uniquement au moyen d’une pompe avec seringue pour perfusion ou d’un dispositif de perfusion avec
doseur. Le citrate de caféine peut être utilisé soit pur, soit dilué dans des solutions stériles pour
perfusion telles que du glucose 50 mg/ml (5 %), du chlorure de sodium 9 mg/ml (0,9 %) ou du
gluconate de calcium 100 mg/ml (10 %) immédiatement après avoir été retiré de l’ampoule (voir
rubrique 6.6).
4.3 Contre-indications
Hypersensibilité au principe actif ou à l’un des excipients mentionnés à la rubrique 6.1.
4.4 Mises en garde spéciales et précautions d’emploi
Apnée
L’apnée du nouveau-né prématuré est un diagnostic d’exclusion. Les autres causes d’apnée (par ex.
troubles du système nerveux central, pneumopathie primaire, anémie, septicémie, troubles
métaboliques, anomalies cardiovasculaires ou apnée obstructive) devront être exclues ou correctement
traitées avant l’instauration du traitement par le citrate de caféine. Une absence de réponse au
traitement par la caféine (confirmée si besoin par la mesure des concentrations plasmatiques) peut
révéler une autre cause d’apnée.
Consommation de caféine
Chez les nouveau-nés dont la mère a consommé de grandes quantités de caféine avant
l’accouchement, la mesure initiale des concentrations plasmatiques de caféine devra être réalisée avant
l’instauration du traitement par le citrate de caféine, puisque la caféine traverse facilement le placenta
et se retrouve dans la circulation fœtale (voir rubriques 4.2 et 5.2).
4

La caféine étant excrétée dans le lait maternel (voir rubrique 5.2), les mères allaitant leur nouveau-né
traité par le citrate de caféine ne doivent pas consommer d’aliments ou de boissons contenant de la
caféine ou prendre des médicaments à base de caféine (voir rubrique 4.6).
Théophylline
Chez les nouveau-nés précédemment traités par la théophylline, les caféinémies initiales devront être
mesurées avant l’instauration du traitement par le citrate de caféine car les prématurés métabolisent la
théophylline en caféine.
Crises convulsives
La caféine est un stimulant du système nerveux central et des crises d’épilepsie ont été rapportées lors
de surdosage par la caféine. Il convient de faire preuve d’une extrême prudence en cas d’utilisation du
citrate de caféine chez des nouveau-nés présentant des troubles épileptiques.
Réactions cardiovasculaires
Des études publiées ont indiqué que la caféine augmentait la fréquence cardiaque, le débit du
ventricule gauche et le débit systolique. Le citrate de caféine devra par conséquent être utilisé avec
prudence chez les nouveau-nés présentant une maladie cardiovasculaire connue. Il semble que la
caféine entraîne des tachyarythmies chez les personnes prédisposées. Chez les nouveau-nés, il s’agit
en général d’une simple tachycardie sinusale. Il convient d’administrer le citrate de caféine avec
prudence en cas de troubles du rythme inhabituels sur le tracé cardiotocographique (CTG) avant la
naissance du nouveau-né.
Insuffisance rénale et hépatique
Le citrate de caféine devra être administré avec prudence chez les nouveau-nés prématurés présentant
une insuffisance rénale ou hépatique. Dans une étude de sécurité post-autorisation, la fréquence des
effets indésirables chez un petit nombre de grands prématurés présentant une insuffisance rénale ou
hépatique a semblé être supérieure à celle des prématurés ne souffrant pas de l’insuffisance d’un
organe (voir rubriques 4.2, 4.8 et 5.2). Une adaptation posologique, basée sur la surveillance des
concentrations plasmatiques de caféine, est requise afin d’éviter toute toxicité dans cette population.
Entérocolite nécrosante
L’entérocolite nécrosante est une cause fréquente de morbidité et de mortalité chez les prématurés.
Une association possible entre l’utilisation de méthylxanthines et le développement d’une entérocolite
nécrosante a été rapportée. Toutefois, aucune relation de cause à effet entre l’utilisation de caféine ou
d’autres méthylxanthines et l’entérocolite nécrosante n’a été établie. Comme pour tous les prématurés,
les nouveau-nés traités par le citrate de caféine devront faire l’objet d’une surveillance étroite à la
recherche de signes évocateurs d’une entérocolite nécrosante (voir rubrique 4.8).
Le citrate de caféine devra être utilisé avec prudence chez les nouveau-nés souffrant de reflux gastro-
œsophagien car ce traitement peut exacerber cette pathologie.
Le citrate de caféine provoque une augmentation généralisée du métabolisme, pouvant entraîner des
besoins accrus en énergie et alimentation au cours du traitement.
La diurèse et la perte d’électrolytes induites par le citrate de caféine peuvent nécessiter la correction
des déséquilibres des liquides et des électrolytes.
4.5 Interactions avec d’autres médicaments et autres formes d’interaction
5
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
1
/
27
100%