La démence vasculaire : le début d`une nouvelle ère

4• La Revue canadienne de la maladie d’Alzheimer • Septembre 2003
Épidémiologie
D’après l’Étude canadienne sur la
santé et le vieillissement (ECSV), la
démence vasculaire (DV) est la
deuxième cause la plus fréquente de
la démence, avec 1,5 % de la popu-
lation canadienne âgée de plus de
65 ans qui en souffre1. Dans la foulée
de l’ECSV, l’étude ACCORD (A
Canadian Cohort Study of Cognitive
Impairment and Related Dementias)
a montré que 8,7 % des personnes
orientées vers les cliniques de traite-
ment de la démence au Canada étaient
atteintes de DV2. Outre les patients
souffrant d’une démence causée de
toute évidence par une maladie vascu-
laire cérébrale (MVC), il y a des
patients qui présentent un TCV sans
par ailleurs être atteints de démence.
Dans la population de l’ECSV, on
estime que 2,6 % des sujets souffraient
d’un TCV non accompagné de dé-
mence3, alors que, dans la population
de l’étude ACCORD, ce pourcentage
était de 18 %2.
Le risque de DV augmente avec
l’âge (quoique de façon moins
marquée que le risque de maladie
d’Alzheimer [MA]), et il est en gé-
néral plus élevé chez les hommes
que chez les femmes4. Le taux de
prévalence de la démence subsé-
quente à un AVC est de 25 % envi-
ron5. Le très lourd fardeau de la
MVC et de ses répercussions sur la
fonction cognitive pose un défi gi-
gantesque pour notre société vieil-
lissante.
Classification et
caractéristiques cliniques
Les définitions de la DV ont évolué
depuis quelques années. Dans la DV
conséquente à une MVC, les pre-
mières descriptions étaient axées sur
les infarctus multiples dans les régions
corticale et sous-corticale. Dans cette
forme de DV, l’apparition et l’aggrava-
tion du trouble cognitif sont reliées
chronologiquement à un AVC ou à un
accident ischémique transitoire (AIT).
Pour leur part, les définitions récentes
avancent que la DV est un trouble
hétérogène dont les signes et les
symptômes sont liés à la zone corti-
cale ou sous-corticale touchée par
l’AVC. La détérioration s’effectue en
général par paliers et on observe des
déficits neurologiques en foyer évi-
dents liés aux AVC précédents.
Hachinski a élaboré une échelle
d’évaluation de l’ischémie (score d’is-
chémie de Hachinski) pour aider à dis-
cerner la DV de la MA (Tableau 1)6.
Cette échelle inclut des aspects carac-
téristiques de la DV auxquels on a
Inge Loy-English, M.D., FRCPC
Professeur adjoint
Division de neurologie
Faculté de médecine
Université d’Ottawa
Ottawa (Ontario)
Howard Feldman, M.D., FRCPC
Professeur, division de neurologie
Faculté de médecine
Clinique de la maladie d’Alzheimer et
des démences connexes
Université de la
Colombie-Britannique
Vancouver (Colombie-Britannique)
La démence vasculaire :
le début d’une nouvelle ère
Les connaissances scientifiques sur la démence vasculaire (DV) ont évolué rapidement depuis
10 ans et elles ont élargi le concept de démence à infarctus multiples (DIM). Aujourd’hui, on
reconnaît toute une gamme de syndromes vasculaires cérébraux pouvant entraîner la DV,
notamment l’infarctus lié à une aire cérébrale stratégique, la DV sous-corticale et l’angiopathie
amyloïde. Les chercheurs s’intéressent maintenant au trouble cognitif vasculaire (TCV) sans
démence susceptible d’être traité en corrigeant les facteurs de risque vasculaires et en influant
sur les mécanismes de l’accident vasculaire cérébral (AVC) avant que la démence atteigne le
stade clinique. En effet, des résultats d’études démontrent qu’en traitant les facteurs de risque
vasculaires chez des sujets asymptomatiques on réduit le risque de démence. Les inhibiteurs
de la cholinestérase offrent désormais une nouvelle option thérapeutique pour soulager les
symptômes de la DV, puisque les études cliniques ont démontré leurs effets bénéfiques sur la
cognition, le comportement et la capacité fonctionnelle.
par Inge Loy-English, M.D., FRCPC, et Howard Feldman, M.D., FRCPC

assigné une valeur de 1 ou de 2. Un
score > 7 correspond au diagnostic de
la DV ou de la DIM, un score de 4 à 7
correspond au diagnostic de la démen-
ce mixte et un score < 4 correspond au
diagnostic de la MA ou d’une autre
forme de démence de cause non vas-
culaire.
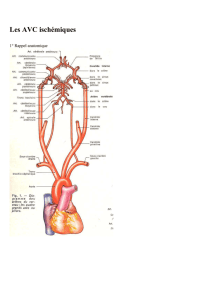
La Figure 1 présente des exemples
de troubles vasculaires qui s’accompa-
gnent à la fois d’un TCV et de la DV.
DIM. Le concept de la DIM
(Figure 1A) a évolué progressive-
ment et inclut maintenant la démence
qui accompagne un plus large éven-
tail de troubles vasculaires cérébraux.
DV sous-corticale. Cette entité
regroupe la maladie de Binswanger et
l’état lacunaire. Son début est insi-
dieux chez plus de 50 % des patients,
et l’évolution par paliers est très rare.
Les patients présentent souvent des
déficits neurologiques en foyer à
l’examen (faiblesse unilatérale ou
bilatérale discrète, signes de Babinski,
déficits sensoriels, dysarthrie), mais
ils ont rarement des antécédents
d’AIT ou d’AVC certains. On note
parfois une démarche atypique
(« marche à petits pas ») attribuable à
des lésions sous-cortico-frontales. Sur
le plan cognitif, on constate un dys-
fonctionnement frontal proéminent
qui se manifeste par des anomalies
des fonctions exécutives (planifica-
tion, enchaînement et organisation).
L’altération de la mémoire dans le
TCV et dans la DV est souvent légère,
surtout en comparaison de la MA; la
perte mnésique porte surtout sur les
rappels plutôt que sur la reconnais-
sance. La tomodensitométrie (TDM)
ainsi que l’imagerie par résonance
magnétique (IRM) – cette dernière
étant plus efficace – mettent en évi-
dence des lésions ischémiques éten-
dues et des infarctus lacunaires dans
les zones profondes et superficielles
de la substance blanche et de la
matière grise, et ce, des deux côtés du
cerveau (Figure 1B).
Infarctus « stratégique ». On
reconnaît de plus en plus l’impor-
tance de ce type d’infarctus dans le
TCV et dans la DV. Bien que, dans
les autres formes de DV, on estime
que le volume total des lésions
cérébrales doit être de 100 cm3pour
que la démence s’installe, dans la
démence à infarctus stratégique, le
dixième seulement de ce volume
suffit pour causer la démence7. Parmi
les exemples de lésions stratégiques,
on note des infarctus dans le thala-
mus, l’hippocampe ou le gyrus angu-
laire dominant (Figure 1C). Le
trouble cognitif d’importance clini-
que est entièrement fonction du siège
des infarctus stratégiques. Dans le cas
des infarctus thalamiques bilatéraux,
on observe parfois un syndrome
amnésique dense accompagné de
paralysie bilatérale de l’élévation du
regard. Une lésion grave du gyrus
angulaire dominant peut causer le
syndrome de Gerstmann (indistinc-
tion droite-gauche, agnosie digitale,
acalculie et agraphie). Il importe de
savoir reconnaître le phénotype de
l’infarctus stratégique unique pour
faciliter le diagnostic précoce et le
traitement.
Hypoperfusion corticale globale.
Il s’agit d’un autre sous-type de DV
survenant après un arrêt cardiaque
(Figure 1D).
Troubles hémorragiques. Ils sont
aussi des sous-types de la DV
(angiopathie amyloïde cérébrale ou
troubles survenant après une hémor-
ragie méningée) (Figure 1E).
CADASIL. Les infarctus multiples
causant la démence ont parfois des
causes héréditaires rares. Une entité
décrite récemment et appelée Cere-
bral Autosomal Dominant Arterio-
pathy with Subcortical Infarcts and
Leukoencephalopathy (CADASIL)
est de plus en plus reconnue comme
une cause de la DV sous-corticale
inexpliquée chez des patients jeunes
ou dans la quarantaine (Figure 1F).
Il importe de souligner que tous les
sous-types de TCV et de DV décrits
auparavant peuvent coexister avec la
MA, ce qui se traduit par une démence
mixte. On a signalé ce type de démence
mixte chez environ 18,7 % de tous les
patients de l’étude ACCORD qui ont
reçu un diagnostic de démence2.
Critères diagnostiques
Dans les recherches sur la DV, on
utilise trois ensembles de critères dia-
gnostiques : 1) les critères du Dia-
gnostic and Statistical Manual of
Mental Disorders (DMS, 4eédition);
2) les critères de la Classification
internationale des maladies et des
problèmes de santé connexes (CIM,
10eédition); 3) les critères du National
Institute of Neurological Disorders
and Stroke (NINDS)-Association
internationale pour la recherche et
l’enseignement en neurosciences
(AIREN)8-10. Bien que ces critères ne
soient pas appliqués systématique-
ment en médecine clinique, il vaut la
peine de tenir compte de certains élé-
ments diagnostiques (Tableau 2).
D’après les critères NINDS-AIREN,
lesquels sont le plus souvent utilisés
dans les études cliniques récentes, on
La Revue canadienne de la maladie d’Alzheimer • Septembre 2003 • 5
Tableau 1
Score d’ischémie de
Hachinski*
Critère Score
Début brusque 2
Aggravation par paliers 1
Évolution fluctuante 2
Confusion nocturne 1
Conservation relative
de la personnalité 1
Dépression 1
Plaintes somatiques 1
Labilité émotionnelle 1
Antécédents d’hypertension 1
Antécédents d’AVC 2
Signes d’athérosclérose 1
Symptômes neurologiques
en foyer 2
Signes neurologiques en foyer 2
* Un score > 7 évoque la DV; un score < 4
évoque la MA ou une autre forme de
démence non vasculaire; un score de 4 à
7 évoque une démence mixte.
D’après Rosen WG et coll. Ann Neurol 1980;
7:486-8.

6• La Revue canadienne de la maladie d’Alzheimer • Septembre 2003
doit démontrer une relation temporelle
avec le début de la démence dans les
trois mois qui suivent le diagnostic
d’un AVC d’importance clinique. En
outre, la neuroimagerie doit mettre en
évidence des lésions ischémiques pour
permettre de poser le diagnostic.
Traitement
Les principes fondamentaux du trai-
tement du TCV et de la DV sont axés
sur la prévention d’autres AVC isché-
miques. Or, des données récentes
appuient le recours aux inhibiteurs de
l’acétylcholinestérase pour traiter la
DV.
Facteurs de risque vasculaires
a) Hypertension. On sait depuis
longtemps que l’hypertension arté-
rielle est un facteur de risque d’AVC
et de DV, mais ce n’est que depuis peu
qu’on connaît les effets bénéfiques du
traitement antihypertensif pour pré-
venir la démence. Les chercheurs de
l’étude Systolic Hypertension in
Europe (Syst-Eur) ont examiné les
effets du traitement de l’hypertension
systolique chez des sujets dans la
quarantaine11. Cette étude compara-
tive à répartition aléatoire, à double
insu et avec témoin placebo avait pour
but de comparer l’efficacité de la
nitrendipine, avec ou sans énalapril et
avec ou sans hydrochlorothiazide, à
celle du placebo pour abaisser la
tension artérielle (TA) systolique à
moins de 150 mm de Hg. Les résultats
ont révélé une diminution de 55 % de
l’incidence de la démence (intervalle
de confiance [IC] de 95 %, 24-73) et
une réduction de 42 % de l’incidence
des AVC (IC de 95 %, 17-60) dans le
groupe de traitement actif12. On a noté
également un nombre moins élevé de
cas de DV et de MA dans le groupe de
traitement actif.
Dans un article synthèse récent
portant sur toutes les études qui ont
évalué les effets du traitement antihy-
pertensif sur le TCV13, les auteurs
concluent que le traitement antihy-
pertensif administré à des personnes
âgées est sûr et efficace pour réduire
la morbidité et la mortalité. Les
inhibiteurs de l’enzyme de conver-
sion de l’angiotensine (ECA) et les
bloqueurs des canaux calciques
(BCC) (surtout la nicardipine et la
nitrendipine) sont appuyés par les
données les plus convaincantes sur le
plan de la prévention du TCV associé
à l’hypertension. En revanche, les
données à l’appui du traitement avec
les diurétiques et les bêta-bloquants
sont moins nombreuses à cet égard.
b) Diabète. La relation entre le
diabète et l’AVC est également bien
connue, et on a démontré récemment
une relation entre le diabète et l’ap-
parition du trouble cognitif. Dans son
article synthèse récent, Cochrane14 a
conclu que le risque de trouble cogni-
tif augmente du double chez les
patients diabétiques, comparative-
ment à la population générale. Bien
que les résultats ne soient pas aussi
concluants quant aux effets du traite-
ment hypoglycémiant pour réduire
Figure 1
Types de DV
A) DIM B) DV sous-corticale C) Infarctus stratégique unique
D) Hypoperfusion E) Trouble hémorragique F) CADASIL

l’incidence de la démence, des
données montrent que la maîtrise de
l’hyperglycémie a un effet favorable
sur la fonction cognitive, du moins à
brève échéance15,16. Ces effets favo-
rables s’ajoutent aux bienfaits évi-
dents de la maîtrise rigoureuse de la
glycémie pour prévenir les complica-
tions diabétiques.
c) AVC. Le traitement avec les inhi-
biteurs de la 3-hydroxy-3-méthylgluta-
ryl-coenzyme A (HMG-CoA) réduc-
tase (statines) est aujourd’hui pratique
courante dans la prévention secondaire
des AVC. L’effet des statines sur le
risque d’AVC chez des patients atteints
de maladie coronarienne a été évalué
dans deux méta-analyses récentes17,18.
Ces analyses portant sur des données
regroupées ont montré que le taux
d’AVC avait diminué d’environ 25 % à
30 %.
La Heart Protection Study (HPS)19
a permis d’évaluer les effets de la
simvastatine sur divers paramètres
vasculaires (AVC, infarctus du myo-
carde [IM] et décès). Dans cette étude
comparative à répartition aléatoire et
à double insu, 20 536 patients ont été
répartis de façon aléatoire pour
recevoir la simvastatine ou le place-
bo. Les risques d’AVC, d’IM et de
décès ont tous diminué significative-
ment dans le groupe de traitement
actif, mais on n’a pas observé d’effet
thérapeutique significatifs de la sim-
vastatine sur les paramètres cognitifs
évalués après cinq ans.
d) L’homocystéine est depuis peu
reconnue comme un facteur de risque
de MVC et de démence. En effet, des
études antérieures ont montré qu’il
existe une relation linéaire indépen-
dante entre le risque d’AIT et d’AVC
et des concentrations croissantes
d’homocystéine20. Le traitement ad-
ministré pour abaisser les concentra-
tions d’homocystéine est bien toléré
et est fondé sur la prise quotidienne de
suppléments de vitamine B6 (25 mg),
de vitamine B12 (de 250 mg à
500 mg) et d’acide folique (de 2 mg
ou 3 mg). Bien qu’aucune étude n’ait
encore été menée pour évaluer spé-
cialement les effets de ce traitement
sur le TCV ou la DV, des études sont
en cours pour examiner la pertinence
de l’homocystéine comme cible
thérapeutique pour abaisser le risque
d’AVC et pour traiter la MA.
Traitement avec les antiplaquet-
taires. Une seule étude comparative à
répartition aléatoire a été menée pour
évaluer les effets des antiplaquet-
taires sur la démence21. Cette étude à
simple insu d’une durée de trois ans a
été menée auprès de 70 patients
atteints de DIM et répartis de façon
aléatoire entre le groupe traité par
l’acide acétylsalicylique (AAS) à
raison de 325 mg ou le groupe ne
recevant pas de traitement (groupe
témoin). Les résultats montrent des
améliorations significatives des para-
mètres de la perfusion cérébrale ainsi
que des scores de la performance co-
gnitive chez les patients traités par
l’AAS, comparativement aux patients
qui n’ont pas reçu de traitement. Cette
étude clinique n’a pas été reproduite,
et aucune autre étude n’a été menée
pour évaluer d’autres antiplaquet-
taires (ticlopidine, clopidogrel, traite-
ment d’association dipyradimole +
AAS) ni la warfarine dans le traite-
ment du TCV ou de la DV.
Traitement symptomatique de la
DV. La description des déficits choli-
nergiques dans la DV et le TCV a mo-
tivé des études cliniques récentes sur le
traitement avec les inhibiteurs de la
cholinestérase. Dans une étude com-
parative à double insu avec placebo, les
chercheurs ont évalué l’innocuité et
l’efficacité du donépézil dans la DV
probable, définie d’après les critères
NINDS-AIREN22. Les résultats révè-
lent des effets bénéfiques dans les
groupes qui ont reçu le donépézil à
La Revue canadienne de la maladie d’Alzheimer • Septembre 2003 • 7
Tableau 2
Critères diagnostiques de la DV probable
DMS-IV CIM-10 NINDS-AIREN
AVC ischémique et AVC hémorragique Oui Oui Oui
Présence de la détérioration par paliers Oui Non Oui (ou relation temporelle entre
l’AVC et la démence)
Distribution inégale des déficits cognitifs Non Oui Non
Signes neurologiques en foyer Oui (ou signes Oui Oui
radiographiques d’une
MVC importante)
Symptômes neurologiques en foyer Oui Non Non
Relation de cause à effet entre l’AVC Oui Oui Oui
et le trouble cognitif
Relation temporelle entre l’AVC et le Non Non Oui
début de la démence
Neuroimagerie des structures Oui (ou signes cliniques Non Oui : plusieurs AVC de gros vaisseaux
cérébrales requise d’une MVC importante) ou lésions lacunaires multiples ou
lésions importantes dans la substance
blanche ou lésions stratégiques uniques

raison de 5 mg ou 10 mg par rapport
au groupe placebo en regard du score
du Clinician’s Interview-based Im-
pression of Change (CIBIC-plus),
une échelle d’évaluation globale; le
score de l’échelle d’évaluation psy-
chométrique de la cognition dans les
cas de MA (ADAS-Cog) a également
été amélioré.
Par ailleurs, une étude comparative
à répartition aléatoire et à double insu a
permis d’évaluer la galantamine chez
des sujets atteints d’une DV probable
et d’une DV mixte (MA-DV)23. Après
six mois, le groupe traité par la galan-
tamine présentait des résultats nette-
ment plus favorables que le groupe
placebo en ce qui concerne les
scores CIBIC-plus et ADAS-Cog.
Aucune étude comparative à répar-
tition aléatoire évaluant l’efficacité de
la rivastigmine dans les cas de DV ou
de démence mixte (MA-DV) n’a
encore été publiée.
Conclusion
Le TCV et la DV forment un groupe
hétérogène d’affections que l’on com-
mence à mieux comprendre avec l’ar-
rivée de critères diagnostiques et de
procédés de neuroimagerie plus effi-
caces. La description phénotypique des
sous-types de TCV et de DV pourrait
aider à mieux cibler les interventions
thérapeutiques. À l’heure actuelle, la
maîtrise énergique des facteurs de
risque vasculaires est certainement une
stratégie primordiale pour prévenir les
lésions ischémiques. Enfin, le recours
aux inhibiteurs de la cholinestérase
pour le traitement symptomatique de la
DV est une intervention appuyée par
des preuves de niveau 1 apportées par
les études comparatives à répartition
aléatoire récentes.
Remerciements
Les auteurs tiennent à remercier le
DrDoug Graeb et le PrPhilip Scheltens
pour les images de TDM et d’IRM uti-
lisées à la Figure 1. Ils remercient éga-
lement chaleureusement M. Jacob
Grand pour son aide à la rédaction de
cet article.
8• La Revue canadienne de la maladie d’Alzheimer • Septembre 2003
Références
1. Lindsay J, Hebert R, Rockwood K.
« The CSHA: risk factors for vascular
dementia », Stroke 1997;28:526-30.
2. Feldman H et coll. « A Canadian Cohort
Study of Cognitive Impairment and
Related Dementias (ACCORD): Study
methods and baseline results », Neuro-
epidemiology 2003;22(5): 265-74.
3. Rockwood K et coll. « Prevalence and
outcomes of vascular cognitive impair-
ment: vascular cognitive impairment
investigators of the CSHA », Neurology
2000;54(2):447-51.
4. Hebert R et coll. « Vascular dementia:
incidence and risk factors in the
CSHA », Stroke 2000;31(7):1487-93.
5. Qiu C, Skoog I, Fratiglioni L. « Occur-
rence and determinants of vascular
cognitive impairment ». Dans :
Erkinjuntti T, Gauthier S (éd.). Vascular
Cognitive Impairment. Martin Dunitz,
London, 2003, p. 61-83.
6. Rosen WG et coll. « Pathological veri-
fication of ischemic score in differen-
tiation of dementias », Ann Neurol
1980;7:486-8.
7. Feldman H. « Treatment of vascular
cognitive impairment/vascular demen-
tia ». Dans : Ancill RJ, Holliday SG,
Mithani AH (éd.). Therapeutics in Ge-
riatric Neuropsychology. John Wiley &
Sons Ltd., Chichester, 1997, p. 13-30.
8. American Psychiatric Association
(APA). Diagnostic and Statistical
Manual of Mental Disorders. APA,
Washington DC, 1994.
9. World Health Organization (WHO). ICD-
10: International statistical classification
of diseases and related health problems.
Based on recommendations of the 10th
Revision Conference, 1989 and adopted
by the 43rd World Health Assembly,
1992-1994. WHO, Genève, 1992.
10. Roman GC et coll. « Vascular demen-
tia: diagnostic criteria for research
studies. Report of the NINDS-AIREN
International Workshop. », Neurology
1993;43:250-60.
11. Forette F et coll. « The prevention of
dementia with antihypertensive
treatment: new evidence from the
Syst-Eur study », Arch Int Med
2002;162 (18):2046-52.
12. Staessen JA et coll. « Randomised
double-blind comparison of placebo
and active treatment for older patients
with isolated systolic hypertension. The
Systolic Hypertension in Europe (Syst-
Eur) Trial Investigators », Lancet 1997;
350:757-64.
13. Amenta F et coll. « Protective effect of
anti-hypertensive treatment on cogni-
tive function in essential hypertension:
analysis of published clinical data »,
J Neurol Sci 2002;203-204:147-51.
14. Areosa SA, Grimley EV. « Effect of the
treatment of Type II diabetes mellitus on
the development of cognitive im-
pairment and dementia », Cochrane
Database.Syst.Rev. 2002;(4): CD003804.
15. Naor M et coll. « Cognitive function in
elderly non-insulin-dependent diabetic
patients before and after inpatient
treatment for metabolic control »,
J Diabetes Complications 1997;
11(1):40-6.
16. Meneilly GS et coll. « The effect of
improved glycemic control on cognitive
functions in the elderly patient with dia-
betes », J Gerontol 1993;48:M117-21.
17. Bucher HC, Griffith LE, Guyatt GH.
« Effect of HMG-CoA reductase
inhibitors on stroke. A meta-analysis of
randomized, controlled trials », Ann
Intern Med 1998;128(2):89-95.
18. Blauw GJ et coll. « Stroke, statins, and
cholesterol. A meta-analysis of ran-
domized, placebo-controlled, double-
blind trials with HMG-CoA reductase
inhibitors », Stroke 1997;28(5):946-50.
19. Heart Protection Study Collaborative
Group. « MRC/BHF Heart Protection
Study of antioxidant vitamin supplemen-
tation in 20,536 high-risk individuals: a
randomised placebo-controlled trial »,
Lancet 2002;360:23-33.
20. Boushey CJ et coll. « A quantitative
assessment of plasma homocysteine as
a risk factor for vascular disease:
Probable benefits of increasing folic
acid intakes », JAMA 1995;274(13):
1049-57.
21. Meyer JS et coll. « Randomized clini-
cal trial of daily aspirin therapy in
multi-infarct dementia. A pilot study »,
JAGS 1989;37(6):549-55.
22. Pratt RD, Perdomo CA. « Donepezil-
treated patients with probable vascular
dementia demonstrate cognitive
benefits », Ann NY Acad Sci 2002;
977:513-22.
23. Erkinjuntti T et coll. « Efficacy of
galantamine in probable vascular
dementia and Alzheimer's disease com-
bined with cerebrovascular disease: a
randomised trial », Lancet 2002;359:
1283-90.
1
/
5
100%