Adénopathies cervicales malignes en apparence primitives

446 | La Lettre du Cancérologue • Vol. XVII - n° 9 - novembre 2008
MISE AU POINT
Adénopathies cervicales malignes
en apparence primitives
Primary cervical lymph nodes metastases
A. Benhammou*, N. Dib*, N. Nazih*, M. Boulaadas*, L. Essakali*, M. Kzadri*
* Service d’ORL et de chirurgie cervico-
faciale, hôpital des spécialités, CHU
Ibn Sina, Rabat, Maroc.
O
n appelle adénopathie (ADP) cervicale
maligne en apparence primitive tout
ganglion cervical dont on a prouvé la
malignité sur le plan histologique et dont le cancer
primitif n’a pas été retrouvé après un bilan complet.
Cette pathologie représente 2 à 9 % des cancers des
voies aérodigestives supérieures (1), et environ 5 %
de l’ensemble des néoplasies avec cancer primitif
inconnu.
Les raisons pour lesquelles la recherche du cancer
primitif demeure infructueuse sont multiples. Il peut
s’agir d’une tumeur de petite taille infraclinique et infra-
radiologique, d’une tumeur sous-muqueuse ou encore
d’une tumeur ayant régressé spontanément (2).
La découverte du primitif est essentielle pour la
conduite thérapeutique. Il se situe dans 80 % des
cas au niveau cervico-facial, notamment au niveau
de l’oropharynx, des sinus piriformes ou des fossettes
de Rosenmüller (1, 2).
Les progrès des techniques d’imagerie, ainsi que
des techniques anatomopathologiques et immuno-
histochimiques ont permis de diminuer l’incidence
de cette pathologie, dont la prise en charge demeure
problématique.
Grâce à une revue de la littérature (recherche
bibliographique réalisée sur Medline), nous nous
proposons de rappeler la démarche diagnostique et
thérapeutique devant une ADP cervicale maligne en
apparence primitive.
Épidémiologie
Comme pour toutes les tumeurs malignes des voies
aérodigestives supérieures, les sujets le plus souvent
atteints sont de sexe masculin, éthylotabagiques,
et âgés de 55 à 65 ans (2).
L’ADP siège dans la majorité des cas au niveau du
territoire sous-digastrique, et le stade ganglion-
naire au moment du diagnostic est un N2. Une
atteinte bilatérale est rapportée dans environ 10 %
des cas (1, 3).
Le carcinome épidermoïde est le type histologique le
plus fréquemment retrouvé, suivi du carcinome indif-
férencié, puis de l’adénocarcinome et des tumeurs
lympho-épithéliales (2, 4).
Démarche diagnostique
La conduite à tenir devant une ADP cervicale préva-
lente repose sur différentes étapes. Il faut tout
d’abord reconnaître l’ADP et prouver sa malignité
avant de rechercher la tumeur primitive grâce à
l’ensemble des examens complémentaires à notre
disposition.
Examen clinique
L’interrogatoire est le premier temps de cette
➤
démarche. Il précisera tout d’abord le terrain : âge,
antécédents éthylotabagiques, origine géographique
et état des vaccinations. En effet, chez un sujet âgé
éthylotabagique, il faudra craindre un carcinome
épidermoïde, alors que, chez un jeune, les hémo-
pathies sont plus fréquentes. Si le patient est origi-
naire du Maghreb ou de l’Asie du Sud-Est, il faudra
penser en premier lieu à un cancer du cavum. On
interrogera ensuite le patient sur ses antécédents
pathologiques, notamment de cancer, d’irradiation
cervicale ou d’autres tares, ainsi que sur ses anté-
cédents familiaux.

La Lettre du Cancérologue • Vol. XVII - n° 9 - novembre 2008 | 447
Résumé
Les adénopathies (ADP) cervicales malignes en apparence primitives sont de plus en plus rares grâce aux progrès réalisés
sur le plan diagnostique. Il s’agit le plus souvent d’une métastase d’un carcinome épidermoïde localisé au niveau des voies
aérodigestives supérieures. La démarche à suivre devant une ADP cervicale suspecte de malignité repose tout d’abord sur
un examen ORL complet, suivi d’examens complémentaires (radiographie pulmonaire, bilan sanguin standard, sérologies,
échographie cervicale et abdominale, TDM et IRM cervico-faciales) dont le but est de fournir des arguments en faveur de
la malignité et de retrouver la lésion primitive. D’autres examens plus invasifs sont à notre disposition lorsque ce premier
bilan s’est révélé négatif, notamment la tomographie par émission de positons, qui permet de faire le diagnostic de la
tumeur primitive dans 21 à 30 % des cas. La panendoscopie des voies aérodigestives est indispensable, avec biopsies au
niveau des zones suspectes. L’amygdalectomie homolatérale à l’ADP est recommandée par tous les auteurs, retrouvant
le primitif à ce niveau dans environ 30 % des cas. La prise en charge thérapeutique repose sur une cervicotomie avec
analyse histologique extemporanée de l’ADP, dont les résultats guideront le geste chirurgical. Celui-ci pourra se limiter
à une simple adénectomie, ou au contraire aller jusqu’au curage ganglionnaire cervical complet, plus ou moins associé
à une thyroïdectomie. Le traitement complémentaire, qui s’appuie sur une radiothérapie ou une chimiothérapie, est
indispensable, car il permet d’améliorer le pronostic, notamment en cas de carcinome épidermoïde.
Mots-clés
Adénopathie cervicale
Carcinome
épidermoïde
Curage ganglionnaire
Radiothérapie
Highlights
Malignant cervical lymph nodes
without primary are extremely
rare thanks to progress in diag-
nosis of the primary. It’s gener-
ally a metastasis of epidermoid
carcinoma, located on the
superior areo-digestive tract.
The examination of the ORL
region is very important, and
radiological findings can find
the primary.
Keywords
Cervical lymph node
Epidermoid carcinoma
Lymph node dissection
Radiotherapy
On s’attardera ensuite sur les caractères de cette
ADP : sa date d’apparition, son mode évolutif (lent
ou rapide), l’existence ou non de signes inflamma-
toires (rougeur, douleur), et enfin son évolution en
cas d’administration d’un traitement antibiotique
ou anti-inflammatoire.
L’interrogatoire sera complété par la recherche ➤
de signes fonctionnels associés pouvant orienter
vers la tumeur primitive. Ainsi, une dysphonie fera
évoquer une tumeur laryngée ; une dysphagie ou une
odynophagie, une tumeur de la cavité buccale, oro-
ou hypopharyngée ; des épistaxis orienteront vers
une tumeur du cavum ou une tumeur sinusienne ;
les signes de dysthyroïdie, les signes digestifs, respi-
ratoires, gynécologiques et généraux ne devront pas
non plus être négligés (5).
L’examen physique débutera par l’analyse de l’ADP.
L’examinateur sera placé derrière le patient et palpera
toutes les aires ganglionnaires cervicales.
On précisera le siège de l’ADP selon les différents
groupes ganglionnaires définis par l’American
Academy of Otolaryngology-Head and Neck Surgery
en 1991. Ainsi, il existe six groupes qui correspondent
à un territoire de drainage lymphatique :
– le groupe I : sous-mentomandibulaire, récemment
subdivisé en Ia (groupe sous-mental) et Ib (groupe
sous-mandibulaire), qui drainent les lèvres, la cavité
buccale et la pyramide nasale ;
– le groupe II : le groupe IIa : sous-digastrique, qui
draine les trois étages pharyngés, la cavité buccale,
le larynx et la glande thyroïde ; et le groupe IIb :
rétrospinal, qui draine le cavum, la loge parotidienne
et l’oreille ;
– le groupe III : sus-omohyoïdien, qui draine le
larynx, les trois étages pharyngés, la thyroïde et la
cavité buccale ;
– le groupe IV : jugulaire inférieur, qui draine le
larynx, l’oro- et l’hypopharynx, la thyroïde, les
organes thoraciques et abdominopelviens ;
– le groupe V : spinal et sus-claviculaire, qui draine
le rhino- et l’oropharynx, la parotide et l’oreille ;
– le groupe VI : préviscéral, qui draine le larynx et
la thyroïde.
On notera ensuite les caractéristiques cliniques
➤
de cette ADP, à savoir sa taille, sa consistance (dure
ou fluctuante), sa mobilité par rapport aux plans
profonds et à la peau, et enfin l’état cutané en regard.
Toutes ces données seront notées sur un schéma
daté.
À ce stade de l’examen, il est déjà possible de
suspecter la nature maligne de l’ADP lorsqu’elle est
dure, fixe, sans caractère inflammatoire et d’évolu-
tion relativement lente. De plus, son siège va rensei-
gner sur l’origine de la tumeur primitive, selon les
territoires de drainage précisés ci-dessus.
Le reste de l’examen ORL devra être complet,
➤
réalisé sous un bon éclairage, comprenant une
inspection et une palpation. On examinera :
– la cavité buccale : lèvres, langue, plancher buccal,
gencives, face interne des joues, loges amygda-
liennes, voile du palais. À ce niveau, le palper bucco-
pharyngé est indispensable, car il permet souvent
de retrouver des lésions indurées de la base de
langue ou des loges amygdaliennes non visibles
à l’inspection ;
– le larynx et le pharynx, par une laryngoscopie indi-
recte, éventuellement complétée par une nasofi-
broscopie ;
– les fosses nasales et le cavum ;
– le conduit auditif externe et le tympan ;
– la région thyroïdienne ;
– la région parotidienne ;
– tout le revêtement cutané, notamment le scalp,
où les lésions passent souvent inaperçues.
Enfin, l’examen général du patient s’attardera
➤
sur toutes les aires ganglionnaires, le foie, la rate
et l’ensemble des autres appareils.
Examens paracliniques
Ils sont indispensables. On débutera par un bilan
général, qui comprendra : une radiographie pulmo-
naire (recherche d’une tumeur intrathoracique ou
d’un foyer tuberculeux), une numération formule
sanguine, celle-ci pouvant révéler des signes en
faveur d’une hémopathie, une vitesse de sédimen-
tation, des sérologies (mononucléose infectieuse,
toxoplasmose, etc.), une intradermoréaction à la
tuberculine.

448 | La Lettre du Cancérologue • Vol. XVII - n° 9 - novembre 2008
Adénopathies cervicales malignes en apparence primitives
MISE AU POINT
Imagerie ◆
L’échographie cervicale
➤
permet tout d’abord de
différencier une ADP cervicale de toute autre masse
du cou. Elle donnera ensuite des signes en faveur de
la malignité de cette ADP : taille supérieure à 8 mm,
forme arrondie (alors que les ADP bénignes sont
de forme ovalaire), hypoéchogénicité avec nécrose
centrale et enfin contours irréguliers. On étudiera
dans le même temps les glandes thyroïde, parotides
et sous-mandibulaires.
L’échographie abdominale
➤
recherchera une
tumeur digestive, gynécologique ou de l’arbre
urinaire, ainsi que d’éventuelles ADP profondes.
La tomodensitométrie (TDM) cervico-faciale
➤
avec injection intraveineuse de produit de contraste
est devenue un examen incontournable dans le bilan
d’une ADP cervicale. L’aspect tomodensitométrique
des ADP métastatiques est assez caractéristique.
Elles sont supracentimétriques, prévasculaires,
hypodenses, avec un liseré périphérique se rehaus-
sant après injection intraveineuse de produit de
contraste, des contours irréguliers et un effacement
de la graisse périvasculaire et périganglionnaire.
La TDM permettra également de rechercher une
lésion primitive au niveau des voies aérodigestives
supérieures et de visualiser les rapports des ADP
avec les gros vaisseaux, ce qui préjugera de leur
“extirpabilité” chirurgicale.
Au terme de ce bilan (examen clinique et TDM), il est
possible de stadifier l’atteinte ganglionnaire selon
la classification de l’Union internationale contre le
cancer (UICC), décrite en 1997 (6) :
– N0 : absence d’ADP.
– N1 : ADP unique de taille inférieure ou égale à
3 cm.
– N2 : ADP dont la taille est comprise entre
3 et 6 cm :
– N2a : ADP unique homolatérale ;
– N2b : ADP multiples homolatérales ;
– N2c : ADP bilatérales ou controlatérales.
– N3 : ADP dont la taille est supérieure ou égale
à 6 cm.
L’imagerie par résonance magnétique (IRM) ➤ a
une meilleure sensibilité que la TDM pour retrouver
une éventuelle tumeur primitive, notamment au
niveau oropharyngé (base de langue). Il n’y a pas
d’aspect caractéristique des ADP malignes à l’IRM
en séquence T1, d’où l’intérêt des séquences avec
injection de gadolinium, qui permettent de mieux
visualiser les lésions centrales de nécrose, et des
séquences avec suppression de graisse.
Le développement de la
➤
tomographie par
émission de positons (TEP) a permis de faire des
progrès considérables ces dernières années dans
le diagnostic des lésions primitives en cas d’ADP
prévalentes. C’est une méthode scintigraphique qui
utilise le fluoro-2-désoxy-D-glucose marqué au fluor
radioactif. Ce marqueur s’accumule dans les cellules
ayant une augmentation de l’activité métabolique
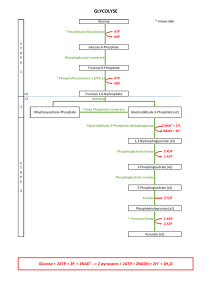
de la glycolyse, entraînant une hyperfixation (7, 8).
C’est le cas des cellules cancéreuses mais également
de tout processus infectieux, inflammatoire et de
cicatrisation, d’où la possibilité de faux positifs. En
outre, au niveau de la sphère ORL, il existe des hyper-
fixations physiologiques, notamment au niveau du
tissu lymphoïde (cavum et amygdales), des lèvres
et des glandes sublinguales (8).
La TEP permet la détection de la tumeur primitive
dans 21 à 30 % des cas où elle n’aurait pas été
retrouvée à la TDM et/ou à l’IRM (9). Idéalement,
elle devrait être réalisée avant toute biopsie afin de
diminuer le risque de faux positif (7, 10), mais ce n’est
pas toujours possible du fait de la non-disponibilité
et du coût de cet examen.
Examens à visée histologique ◆
La cytoponction à l’aiguille fine
➤
est un examen
d’orientation qui reste opérateur-dépendant (11).
Elle est insuffisante pour confirmer la nature histo-
logique de l’ADP.
La panendoscopie des voies aérodigestives
➤
sous
anesthésie générale est l’examen clé de ce bilan. Elle
comprend une pharyngolaryngoscopie, une trachéo-
bronchoscopie, une œsophagoscopie et un examen
du rhinopharynx (1, 3, 5). Toute lésion suspecte
sera biopsiée. Certains auteurs recommandent de
faire des prélèvements multiples, notamment au
niveau de l’oropharynx et des sinus piriformes (2).
Une amygdalectomie homolatérale à l’ADP sera
réalisée systématiquement dans le même temps,
permettant de retrouver le primitif à ce niveau dans
30 à 40 % des cas (12-14). Certaines équipes utilisent
l’autofluorescence (laser-induced fluoroscopy des
Anglo-Saxons) au cours de l’endoscopie. Il s’agit
d’une lumière froide qui produit un aspect caracté-
ristique sur les lésions néoplasiques et qui permet
ainsi de guider les biopsies (15).

La Lettre du Cancérologue • Vol. XVII - n° 9 - novembre 2008 | 449
MISE AU POINT
Prise en charge thérapeutique
La cervicotomie exploratrice avec analyse histolo-
gique extemporanée de l’ADP est le dernier temps
du bilan diagnostique mais également le premier
temps du traitement (1, 3). La biopsie ganglionnaire
simple est contre-indiquée, puisqu’elle entraîne une
rupture capsulaire en cas d’ADP maligne (5), ce qui
aggrave le pronostic.
La conduite thérapeutique à tenir dépendra du
résultat anatomopathologique extemporané (16).
Ainsi, en cas :
– de métastase d’un carcinome épidermoïde, on
effectuera au cours du même temps opératoire un
évidement ganglionnaire complet, associé à une
amygdalectomie homolatérale si celle-ci n’a pas
été réalisée au cours de la panendoscopie ;
– de métastase d’un carcinome indifférencié, on
s’arrêtera à une adénectomie simple ;
– de métastase d’un carcinome papillaire ou vési-
culaire de la thyroïde, on complétera par un curage
complet homolatéral et récurrentiel bilatéral, ainsi
que par une thyroïdectomie totale ;
– de lymphome, l’adénectomie est suffisante ;
– de métastase d’un adénocarcinome, on n’effectuera
pas de geste complémentaire lors de la cervicotomie,
mais il faudra compléter le bilan en postopératoire
à la recherche d’une lésion gastrique, pulmonaire
ou prostatique (17).
Dans la totalité des cas, le traitement effectué lors de
cette cervicotomie est insuffisant et sera complété
par une radiothérapie et/ou une chimiothérapie, en
fonction des résultats de l’analyse anatomopatho-
logique définitive.
Devant une métastase d’un carcinome épidermoïde,
le traitement complémentaire sera une radiothérapie
externe de 60 à 70 Gy sur les aires ganglionnaires
(de façon bilatérale), le pharyngo-larynx et la cavité
buccale (2, 18, 19).
En cas de métastase d’un carcinome indifférencié, le
patient bénéficiera, en postopératoire, d’une radio-
chimiothérapie, avec irradiation des aires ganglion-
naires cervicales et du cavum (4).
S’il s’agit d’un lymphome, le traitement reposera
sur une chimiothérapie.
Devant un adénocarcinome thyroïdien, on complé-
tera le traitement par une IRAthérapie.
Enfin, en cas de métastase d’un adénocarcinome non
identifié, la radiothérapie ne semble pas améliorer
le pronostic, qui est médiocre (17).
Évolution
La tumeur primitive après traitement apparaît, dans
7 à 60 % des cas, dans un délai moyen de 2 ans.
Cette différence de pourcentage selon les séries
s’explique par les différentes modalités thérapeu-
tiques. Ainsi, chez les patients ayant été traités par
chirurgie seule, le cancer primitif se manifeste plus
souvent que chez les patients ayant été irradiés en
postopératoire (1, 18, 20).
La rechute ganglionnaire survient également selon
un pourcentage très variable (0 à 50 %) des cas,
selon le traitement initial (18).
Enfin, l’évolution peut être marquée, dans 10 à 20 %
des cas, par l’apparition de métastases à distance sans
que la tumeur primitive ait été retrouvée (18, 21).
Pronostic
Les facteurs pronostiques des adénopathies cervi-
cales malignes en apparence primitives sont les
mêmes que pour toutes les tumeurs des voies aéro-
digestives supérieures, c’est-à-dire (1, 16) :
– délai thérapeutique ;
– type histologique ;
– stade ganglionnaire ;
– degré de différenciation ;
– présence d’une rupture capsulaire ;
– présence d’emboles vasculaires ou nerveux.
Conclusion
La prise en charge d’une ADP cervicale maligne
en apparence primitive est délicate, nécessitant
un bilan complet et exhaustif afin de retrouver la
tumeur primitive et d’éviter au patient les désa-
gréments d’une irradiation étendue. Le pronostic
est essentiellement lié à des facteurs histologiques
et aux différents moyens thérapeutiques utilisés,
l’association radiochirurgicale étant la moins péjo-
rative, notamment pour les carcinomes épider-
moïdes. ■
1. Jereczek-Fossa BA, Jassem J,
Orecchia R. Cervical lymp node
metastases of squamous cell
carcinoma from an unknown
primary. Cancer Treat Review
2004;30(2):153-64.
2. Nieder C, Grégoire V, Kian
Ang K. Cervical lymph node
metastases from occult squamous
cell carcinoma: cut down a tree to
get an apple? Int J Radiat Oncol
Biol Phys 2001;50(3):727-33.
3. Pavlidis N, Briasoulis E,
Hainsworth J, Greco FA.
Diagnostic and therapeutic
management of cancer of an
unknown primary. Eur J Of Cancer
2003;39:1990-2005.
4. Issing WJ, Taleban B, Tauber S.
Diagnosis and management of
carcinoma of unknown primary
in the head and neck. Eur Arch
Otorhinolaryngol 2003;260:
436-43.
5. Reyt E, Righini C. Adénopathies
cervicales. Encycl Méd Chir (Else-
vier, Paris), Oto-Rhino-Laryngo-
logie, 20-870-A-10, 1999, 10 p.
6. Union internationale contre
le cancer (International Union
Against Cancer). TNM classifi-
cation of malignant tumors. 4th
ed. Berlin : Springer, 1997.
7. Wong WL, Saunders M. The
impact of FDG PET on the mana-
gement of occult primary head
and neck tumours. Clin Oncol
2003;15:461-6.
8. Stokkel MPM, Terhaard CH,
Hordijk GJ, Van Rijk PP. The
detection of unknown primary
tumors in patients with cervical
metastases by dual-head positron
emission tomography. Oral Oncol
1999;35:390-4.
9. Regelink G, Brouwer J,
de Bree R et al. Detection of
unknown primary tumours and
distant metastases in patients
with cervical metastases: value
of FDG-PET versus conventional
modalities. Eur J Nucl Med 2002;
29:1024-30.
10. Jungehülsing M, Scheid-
hauer K, Damm M et al.
2[F]-fluoro-2-deoxy-D-glucose
positron emission tomography
is a sensitive tool for the detec-
tion of occult primary cancer
(carcinoma of unknown primary
syndrome) with head and neck
lymph node manifestation.
Otolaryngol Head Neck Surg
2000;123(3):294-301.
11. Sack MJ, Weber RS, Wien-
stein GS et al. Image guided fine
needle aspiration of the head and
neck: five years’ experience. Arch
Otolaryngol Head Neck Surg
1998;124:1155-61.
Références
bibliographiques
Retrouvez l’intégralité des références bibliographiques sur www.edimark.fr

474 | La Lettre du Cancérologue • Vol. XVII - n° 9 - novembre 2008
Adénopathies cervicales malignes en apparence primitives
mise au point
12. Righi PD, Sofferman RA. Screening unilateral tonsillectomy
in the unknown primary. Laryngoscope 1995;105:548-50.
13. Lapeyre M, Malissard L, Peiffert D et al. Cervical lymph
node metastasis from an unknown primary: is a tonsillectomy
necessary? Int J Radiat Oncol Biol Phys 1997;39:291-6.
14. Randall DA, Johnstone PA, Foss RD, Martin PJ. Tonsillec-
tomy in the diagnosis of the unknown primary tumors of
the head and neck. Otolaryngol Head Neck Surg 2000;
122:52-5.
15. Kulapaditharom B, Boonkitticharoen V, Kunachak S.
Fluorescence-guided biopsy in the diagnosis of an unknown
primary cancer in patients with metastatic cervical lymph
nodes. Ann Otol Rhinol Laryngol 1999;108:700-4.
16. Yalin Y, Pingzhang T, Smith GH, Ilankovan V. Mana-
gement and outcome of cervical lymph node metastases
of unknown primary sites: a retrospective study. Br J Oral
Maxillofac Surg 2002;40:484-7.
17. Zuur CL, Van Velthuysen MLF, Schornagel JH, Hilgers FJM,
Balm AJM. Diagnosis and treatment of isolated neck metastases
of adenocarcinomas. Eur J Surg Oncol 2002;28(2): 147-52.
18. Erkal HS, Mendenhall WM, Amdur RJ, Villaret DB,
Stringer SP. Squamous cell carcinomas metastatic to
cervical lymph nodes from an unknown head and neck
mucosal site treated with radiation therapy alone or in
combination with neck dissection. Int J Radiat Oncol Biol
Phys 2001;50(1):55-63.
19. Strojan P, Anjin A. Combined surgery and postoperative
radiotherapy for cervical lymph node metastases from an
unknown primary tumour. Radiother Oncol 1998;49(1):
33-40.
20. Friesland S, Lind MG, Lundgren J, Munck-Wikland E,
Fernberg JO. Outcome of ipsilateral treatment for patients
with metastases to neck nodes of unknown origin. Acta
Oncol 2001;40:24-8.
21. Grau C, Johansen LV, Jakobsen J et al. Cervical lymph
node metastases from unknown primary tumours. Results
from a national survey by the Danish Society for Head and
Neck Oncology. Radiother Oncol 2000;55:121-9.
Références bibliographiques (suite de la p. 449)
1
/
5
100%