Préservation de la fertilité en 2015

05.10.15 1
Préservation de la fertilité chez les patientes
atteintes de cancer du sein:
Actualités en 2015
Ornite GOLDRAT
Laboratoire de Recherche en Reproduction Humaine, ULB
Service de Gynécologie-Obstétrique, Clinique de la Fertilité, Erasme

INCIDENCE DU CANCER DU SEIN CHEZ LES
JEUNES FEMMES
Merlo et al., 2012

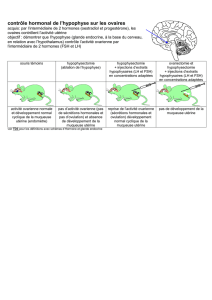
RESERVE OVARIENNE: PHYSIOPATHOLOGIE
05.10.15 3
Réduction de la
réserve
ovarienne
Insuffisance
ovarienne
1x106
5x105
25000
1000

GROSSESSE APRES CANCER DU SEIN:
GONADOTOXICITE DE LA CHIMIOTHERAPIE
05.10.15 4
diminution de la
fertilité voire une
défaillance ovarienne
prématurée
Cet effet dépend de
- l’âge
- l’agent utilisé
- la dose cumulée

05.10.15 5
AMENORRHEE APRES CANCER DU SEIN
Garcia et al. 2012
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
1
/
32
100%