BIO241_ET1_corrigé_Mai12

BIO241 Examenterminal1èresession(21mai2012)
Documentsetcalculatricesnonautorisés
ATTENTION:LespartiesA,BetCdoiventêtretraitéessurdescopiesséparées
9pages
Notationsur80
PartieA:C.Breton(25points)
Question1–Protéines(6points)
a) Soient3protéinesmembranairesA,BetC.Enfonctiondesindicationsdonnéesci‐dessous
pources3protéines,illustreràl’aided’unschémalafaçondontcesprotéinessontassociées
àlamembrane:
Aestuneprotéinepolytopique
BetCsontdesprotéinesmonotopiques.
AetCsontdesprotéinesintrinsèques
Bestuneprotéineextrinsèque
Schémaàfaire(vuencours)
b) LaprotéinePestmodifiéeparN‐acétylationauniveaud’unrésiduLysine.Donnerlaréaction
etl’incidencedecettemodificationsurlafonctiondelaprotéine.
Ajout d’un groupement CO-CH3 sur la fonction -amine
‐(CH2)4‐NH3+→‐(CH2)4‐NH‐CO‐CH3
CetteMPTneutraliselacharge+etintroduitungroupementhydrophobe.Enmodifiantlachargeet
la taille de la chaîne latérale des résidus lysine cela modifie son microenvironnement protéique,
éventuellement sa conformation) et le mode d’interaction avec ses molécules cibles (ex :
histones/ADN)
C’estunemodificationréversible
Question2–Métabolisme(19points)

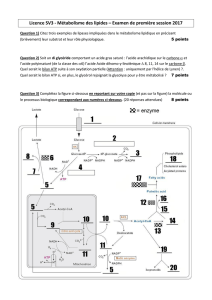
Legrapheci‐dessusdonneleprofild’énergiedelaglycolyse.
a) Donnerlesnomsdeshuitmétabolitesintermédiairesdelaglycolyse(a,b,c,….i)etdes
enzymes(1,2,3)quicatalysentlesréactionsindiquéespardesflèches.Quelleest
l’importancedecesenzymesdanslaglycolyse?
a‐ Glc‐6Pf‐1,3‐BPG
b‐ Fru‐6Pg‐3‐PG
c‐ Fru‐1,6‐bisP h‐2‐PG
d‐ DHAPi‐PEP
e‐ GAP
1‐ HK,2‐PFK,3‐PK
Ces3enzymessontlespointscléderégulationdelaglycolyse
b) Pourquoiappellet’onlapremièrepartiedelaglycolyse,phased’investissementenénergie?
Parcequecettepremièrephase(réactions1‐5)nepermetpasdeproduiredel’ATP.Au
contraire,lesréactions1et3consommentunATP
c) D’unefaçongénérale,quelssontlesmoyensutilisésparlacellulepourrégulerl’activitédes
enzymesclédesvoiesmétaboliques?
- régulation génétique (influe sur le nombre de molécules de E produites)
- régulation allostérique (activateur/inhibiteur qui influe sur la vitesse de la
réaction)
- modification covalente (passage d’une forme d’enzyme on / off) ex :
phosphorylation
Autres réponses acceptées
-disponibilité des S et co-enzymes
-retro-inhibition

d) LaGlycéraldéhyde‐3P‐deshydrogénase(G3PDH)peut‐êtreinhibéeparl’iodoacétate.
‐ Rappelerlaréactionprécisecatalyséeparcetteenzyme(donnerjustelesnomspasles
formules).
GAP+Pi+NAD+→1,3‐BPG+NADH,H+
‐ Envousaidantdugrapheci‐dessus,àvotreavis,quelmétaboliteintermédiaireva
s’accumulerleplusrapidement,encasd’inhibitiondelaG3PDH?Justifiervotreréponse.
Réponse : Fru1,6-bis-P
Car si la première conséquence sera l’accumulation des triose-P, très vite l’équilibre (déjà peu
favorable) sera déplacé dans le sens de la formation du Fru1,6bisP
e) D’aprèslesconcentrationscellulairesdesmétabolites,mesuréesdanslemuscleaurepos,
donnéesci‐après:[Fructose‐6‐P]=1mM,[Fructose‐1,6‐bisP]=10mM,[ATP]=5mM,
[ADP]=0,5mM,[AMP]=0,1mMet[Pi]=10mM
Indiquersilaréactioncatalyséeparlaphosphofructokinasedanslemuscleseraplusoumoins
exergoniquequelamêmeréactionréaliséeenconditionsstandard.
Réponse:
G’=G°’+RTLn[F26BP]x[ADP]/[F6P]x[ATP]
G’=G°’+RTLn[10]x[0,5]/[1]x[5]
G’=G°’Donclaréactionn’estpasplusnimoinsexergonique
f) leglucose‐6‐phosphateestuncarrefourmétaboliqueimportant.Ilaplusieursdestins
possibles.Indiquer3decesdestins:
glycolyse,néoglucogenèse,synthèsedeglycogène,...
g) Quelleestlafonctionduglucagon?Quandcettemoléculeestproduite,quelestsonimpact
surlemétabolismeduglycogène,laglycolyseetlanéoglucogenèseauniveaudescellules
hépatiques?
Ils’agitd’unehormonehyperglycémianteproduiteparlepancréasetdontl’actionestd’augmenter
laconcdeglucosedanslesang
Elleaugmentelaglycogénolyse,elleactivelanéoglucogenèseetinhibelaglycolyse.
h) Unindividuquisouffred’unedéficienceenGlucose‐6‐phosphatasesouffred’hypoglycémie
chronique.Expliquerpourquoi.
C’esteneffetl’enzymedelavoienéoglucogenèsepermettantdereformerduglucoseàpartirdeGlc‐
6‐Pdanslefoie.LeGlcestensuiteexcrétédanslacirculation.
PARTIE B
Bioénergétique et Enzymologie : cours de Mme F. Cornillon

Question 1
Les protéases sont des enzymes peu spécifiques qui catalysent l'hydrolyse
des liaisons peptidiques au sein de protéines très diverses. On peut néanmoins
noter que selon les protéases les liaisons peptidiques hydrolysées ne sont pas les
mêmes, on parle alors de spécificité de coupure selon les protéases.
Quelle est la spécificité de coupure de la chymotrypsine, protéase pancréatique
largement étudiée depuis 1950 ?
dans le sens N-›C, après les aa aromatiques, Tyr, Trp ou Phe.
Qu'est-ce qui garantit, au niveau du site actif de la chymotrypsine, cette
spécificité de coupure ?
C'est une poche profonde et hydrophobe appelée S1 pocket
Ecrire, en formules semi-developpées, la réaction catalysée par la chymotrypsine
en prenant un exemple de votre choix mettant en évidence cette spécificité de
coupure.
Rnterm-PheCH-CO-NH-CH-RCterm+H2O RNterm-PheCH-CO-OH +N+H3-CH-RCterm
Question 2
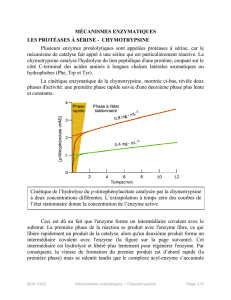
L'étude enzymatique de la chymotrypsine s'effectue pour plus de commodité sur
un substrat artificiel, le para-nitrophénylacétate (pNPA) car le produit
d'hydrolyse, le paranitrophénol (pNP), absorbe à 410 nm.
Les études cinétiques de la réaction pNPA + H2O pNP + acétate
catalysée par la chymotrypsine, ont donné les résultats suivants.
Ces résultats ont permis de mettre en évidence que la réaction se faisait en deux
temps, une étape rapide et une étape limitante.
Quels sont les produits libérés au cours de chacune de ces deux étapes ? Justifier
à l'aide de la courbe.
Pente élevée en 1ere partie : vitesse de libération de pNP rapide

pente plus faible en 2nd partie : vitesse de libétation de pNp plus lente limitée par
la libération de l'acétate.
Donc P1 = pNP et P2 = acétate
L'étape limitante s'explique par la formation d'un intermédiaire covalent entre un
acide aminé clé de la chymotrypsine et la partie du substrat qui correspond au
second produit, libéré dans un deuxième temps.
Quel est cet acide aminé clé du site catalytique de la chymotrypsine ? Donner
son nom et sa position dans le cas de la chymotrypsine.
SER 195
Détailler la structure de l'intermédiaire réactionnel covalent entre cet acide aminé
clé et la partie du substrat correspondante.
SER 195- CH2 – O – CO – CH3 (acétate)
D'autres études ont permis de mettre en évidence l'existence de 2 autres acides
aminés catalytiques dans le site actif de la chymotrypsine.
Quels sont ces deux autres acides aminés du site catalytique de la
chymotrypsine ? Donner leur nom et leur position dans le cas de la
chymotrypsine.
HIS 57 et ASP 102
Ecrire, en les positionnant correctement les uns par rapport aux autres, les
chaînes latérales des 3 acides aminés de la triade catalytique de la
chymotrypsine.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
1
/
14
100%