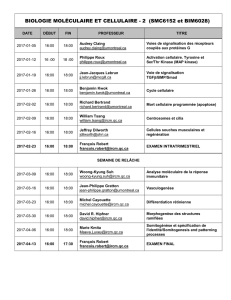
Télécharger le communiqué en format PDF

COMMUNIQUÉ
Pour diffusion immédiate
…2/
Des chercheurs de l’IRCM découvrent une nouvelle fonction
pour un acteur important dans la réponse immunitaire
Cette percée contribue à expliquer un rare syndrome d’immunodéficience
Montréal, le 27 mars 2014 – Des chercheurs de l’IRCM dirigés par Javier M. Di Noia, Ph. D., ont découvert
une nouvelle fonction de l’AID, un enzyme essentiel pour la réponse immunitaire. Cette percée, récemment
publiée par la revue scientifique Proceedings of the National Academy of Sciences (PNAS), contribue à
expliquer une maladie génétique rare qui cause un syndrome d’immunodéficience.
L’équipe de recherche à Montréal étudie l’enzyme AID (activation-induced deaminase) qui se trouve dans les
lymphocytes B, soit le groupe de globules blancs responsables de la production des anticorps qui servent à
combattre les infections). L’AID crée des mutations délibérées dans l’ADN afin de modifier les gènes d’anticorps,
ce qui est requis pour produire une réponse immunitaire appropriée. Toutefois, un mauvais fonctionnement de
l’AID peut avoir des effets néfastes et mener à certaines mutations d’oncogènes (qui causent le cancer).
« Un des rôles de l’AID est de provoquer la commutation de classe d’anticorps, un mécanisme essentiel pour les
réponses immunitaires. La commutation de classe est le processus qui permet aux cellules B de produire différentes
classes d’anticorps de façon à ce que le système immunitaire puisse éliminer une grande variété d’antigènes » a
expliqué le Dr Di Noia, directeur de l’unité de recherche sur les mécanismes de diversité génétique à l’IRCM.
L’AID déclenche un mécanisme selon lequel une rupture se produit dans l’ADN, dans les gènes d’anticorps, et
un des segments est retiré. Les extrémités de chaque côté de la section retirée doivent être réunis pour
réparer le brin d’ADN et, ainsi, produire une nouvelle classe d’anticorps.
« AID est non seulement responsable de déclencher la commutation de classe, mais nous avons aussi
découvert qu’il facilite la réparation de l’ADN pendant ce processus. Par ailleurs, nous avons identifié la
région de l’enzyme qui contrôle cette nouvelle activité. Ces résultats démontrent que l’AID fournit un lien
entre les étapes de dommage et de réparation de l’ADN lors de la commutation de classe » a dit Astrid Zahn,
Ph. D., chercheuse associée au laboratoire du Dr Di Noia et première auteure de l’étude.
« Notre étude contribue également à expliquer une maladie rare nommée syndrome d’hyper-IgM de type 2
(HIGM2) qui est causé par des mutations affectant l’AID. Cette maladie fait partie d’une famille de troubles
génétiques selon laquelle les patients produisent seulement des immunoglobulines M (la classe d’anticorps
produite par défaut par les lymphocytes B), sans produire aucune autre classe d’anticorps suscitée lors
d’infections. Cela compromet de façon considérable la capacité du système immunitaire à lutter contre les
maladies infectieuses » a ajouté la Dre Zahn.
Dans le génome humain, deux copies (ou allèles) d’un gène existent pour chaque protéine, soit une copie
provenant de chaque parent. HIGM2 est habituellement causé par une absence totale d’AID puisque les deux
allèles du gène sont désactivés. Cependant, dans environ 10 % des patients, un seul allèle d’AID est muté. Cet
enzyme muté est donc dominant, car il cause la maladie malgré la présence simultanée d’AID normal dans le
lymphocyte B. Les chercheurs ont constaté que toutes les variantes mutées d’AID manquaient précisément la
région identifiée par leur étude comme étant importante pour la réparation de l’ADN.
« Chez les patients atteints d’HIGM2, l’absence de cette région rend l’AID exceptionnellement efficace pour
endommager l’ADN sans avoir la capacité de déclencher les mécanismes nécessaires pour la réparation. Par
conséquent, l’AID muté perturbe le mécanisme normal de commutation de classe et devient toxique pour les
lymphocytes B, causant ainsi le syndrome d’immunodéficience » a conclu le Dr Di Noia.

/2
À propos de l’étude
Les travaux du Dr Di Noia ont été subventionnés par les Instituts de recherche en santé du Canada et le
Programme des chaires de recherche du Canada. Le projet a été mené à l’IRCM par Astrid Zahn, Anil K.
Eranki, Anne-Marie Patenaude, Stephen P. Methot, Paul Foster et Javier M. Di Noia, en collaboration avec
Ramiro E. Verdun, Ph. D., de la Miller School of Medicine à la University of Miami, ainsi que la Dre Anne
Durandy de l’Hôpital Neckers-Enfants malades à Paris.
Pour plus d’information, veuillez consulter le sommaire de l’article publié en ligne par PNAS.
À propos de Javier M. Di Noia
Javier Marcelo Di Noia a obtenu un doctorat en biochimie de la University of Buenos Aires en Argentine. Il
est professeur agrégé de recherche IRCM et directeur de l’unité de recherche sur les mécanismes de
diversité génétique. Le Dr Di Noia est aussi professeur-chercheur agrégé au Département de médecine
(accréditation en biochimie et en microbiologie et immunologie) de l’Université de Montréal, ainsi que
professeur associé au Département de médecine (Division de la médecine expérimentale) de l’Université
McGill. Il est titulaire de la Chaire de recherche du Canada sur la diversité génétique. Pour plus
d’information, visitez le www.ircm.qc.ca/dinoia.
À propos de l’IRCM
Créé en 1967, l’Institut de recherches cliniques de Montréal (www.ircm.qc.ca) regroupe aujourd’hui 35 unités
de recherche œuvrant dans des domaines aussi variés que l’immunité et les infections virales, les maladies
cardiovasculaires et métaboliques, le cancer, la neurobiologie et le développement, la biologie intégrative
des systèmes et la chimie médicinale, et la recherche clinique. Il compte aussi quatre cliniques de recherche
spécialisées (cholestérol, diabète et obésité, fibrose kystique, hypertension), huit plateaux technologiques et
trois plateformes de recherche dotées d’équipement à la fine pointe de la technologie. Plus de 425
personnes y travaillent. L’IRCM est une institution autonome affiliée à l’Université de Montréal et sa clinique
est associée au Centre hospitalier de l’Université de Montréal (CHUM). L’Institut entretient également une
association de longue date avec l’Université McGill. L’IRCM est financé par le ministère de l’Enseignement
supérieur, de la Recherche, de la Science et de la Technologie du Québec.
- 30 -
Pour plus d’informations ou pour une entrevue avec le Dr Di Noia, veuillez communiquer avec :
Julie Langelier, Chargée de communication (IRCM)
[email protected] | (514) 987-5555
Lucette Thériault, Directrice des communications (IRCM)
[email protected] | (514) 987-5535
1
/
2
100%