Roche obtient l`homologation européenne d`Avastin en association

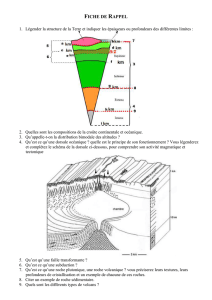
Communiqué de presse
F. Hoffmann-La Roche SA 4070 Bâle
Suisse
Group Communications
Relations avec les médias,
groupe Roche
Tél. +41 61 688 88 88
Fax +41 61 688 27 75
www.roche.com
1/5
Bâle, le 8 juin 2016
Roche obtient l’homologation européenne d’Avastin en association avec Tarceva
pour le traitement de patients atteints d’un type particulier de cancer du poumon
avancé
Il s’agit de la première homologation d’Avastin en association avec un autre traitement ciblé
Roche (SIX: RO, ROG; OTCQX: RHHBY) a annoncé aujourd’hui que la Commission européenne a autorisé
l’utilisation d’Avastin
®
(bevacizumab) en association avec Tarceva
®
(erlotinib) pour le traitement de première
ligne des patients atteints de cancer du poumon non à petites cellules (NSCLC) non épidermoïde, non
opérable, au stade avancé, métastatique ou récidivant, présentant des mutations activant le récepteur du
facteur de croissance épidermique (EGFR – Epidermal Growth Factor Receptor).
L’étude pivot de phase II JO25567 a montré une réduction statistiquement significative du risque relatif de
progression de la maladie ou de décès de l’ordre de 46% (PFS médiane: 16,0 mois vs 9,7 mois; HR=0,54;
p=0,0015) pour les patients recevant l’association Avastin plus Tarceva par rapport à ceux traités par Tarceva
administré seul.
1
Avastin et Tarceva ciblent tous deux des voies de signalisation connues pour jouer un rôle
clé dans le développement et la croissance des tumeurs. L’effet bénéfique de l’association Avastin plus
Tarceva est corroboré par les résultats d’autres études cliniques qui ont démontré son efficacité et sa
tolérance.
2,3
«L’association Avastin plus Tarceva représente un nouveau traitement de référence pour les patients
souffrant de ce type de cancer du poumon, a déclaré Sandra Horning, M.D., Chief Medical Officer et Global
Head of Product Development. Grâce à cette homologation, les médecins européens disposent d’une
association thérapeutique efficace qui permet de prolonger de manière significative la survie sans progression
au-delà d’un an, ce qui en fait une avancée majeure pour une population de patients qui est généralement
confrontée à un pronostic défavorable.»
Chaque année, on estime que 23 000 personnes reçoivent en Europe un diagnostic de NSCLC non
épidermoïde exprimant des mutations activant l’EGFR, soit plus de 60 diagnostics par jour.
4-8
Le NSCLC est

2
/
5
le type le plus fréquent de cancer du poumon, principale cause de décès attribuable au cancer en Europe et
dans le monde.4,7-9 Parmi tous les cancers, le cancer du poumon a le plus grand impact économique et sociétal
dans le monde, raison pour laquelle l’amélioration des résultats pour les patients atteints de ce cancer
constitue un défi primordial en matière de soins de santé à l’échelle mondiale.10
A propos de l’étude JO25567
L’étude JO25567, étude de phase II randomisée, menée par Chugai, a évalué l’innocuité et l’efficacité d’un
traitement de première ligne par Avastin en association avec Tarceva, par comparaison avec Tarceva
administré seul, chez des patients japonais atteints de NSCLC non épidermoïde de stade avancé présentant
des mutations activant l’EGFR. Les données de l’étude portant sur 154 patients ont montré les éléments
suivants.
Les patients ayant reçu Avastin plus Tarceva ont vécu 6,3 mois de plus (valeur médiane) sans progression
de la maladie (survie sans progression, PFS) (critère d’évaluation primaire) que ceux ayant reçu Tarceva
administré seul, ce qui représente une réduction statistiquement significative de 46% du risque relatif de
progression de la maladie ou de décès (PFS médiane: 16,0 mois contre 9,7 mois; [HR]=0,54; p=0,0015)1.
Aucun nouvel événement indésirable cliniquement significatif n’a été observé et le profil de toxicité s’est
avéré gérable1.
A propos de Roche dans le cancer du poumon
Le cancer du poumon est un domaine d’intérêt et d’investissement majeur, et Roche est déterminée à
développer de nouveaux médicaments, tests et approches susceptibles de venir en aide aux patients atteints
de cette maladie mortelle. Roche a pour ambition de fournir des options thérapeutiques efficaces à chaque
patient chez qui un cancer du poumon a été diagnostiqué. Le groupe dispose actuellement de trois
médicaments homologués pour traiter certains types de cancer du poumon et de plus de dix médicaments en
cours de développement destinés à cibler les facteurs génétiques les plus fréquents du cancer du poumon ou à
stimuler le système immunitaire pour combattre la maladie.
A propos du NSCLC avec mutations activant l’EGFR
Le cancer du poumon est la première cause de décès attribuable au cancer en Europe et dans le monde.4,9 En
Europe, il fait plus de victimes que les cancers du sein et de la prostate réunis4: chaque année, plus de
250 000 personnes y décèdent des suites de cette maladie, ce qui équivaut à plus de 700 décès par jour4. Le
NSCLC est le type de cancer du poumon le plus courant; il représente 85% de l’ensemble des cas
diagnostiqués7,8.

3
/
5
Le récepteur du facteur de croissance épidermique (EGFR) est une protéine située sur la membrane cellulaire
qui fait partie de la voie de signalisation cellulaire normale. Un NSCLC avec mutations activant l’EGFR
apparaît lorsqu’une mutation se produit dans une zone particulière de l’ADN du gène EGFR (généralement,
l’exon 19 et l’exon 21), ce qui conduit à une modification de la structure et de la fonction des protéines EGFR
et entraîne une activité permanente de la voie de signalisation EGFR. Ces transformations peuvent être à
l’origine d’une croissance et d’une division cellulaires accélérées, d’une angiogenèse et du développement de
métastases. Environ 10% à 15% des Européens atteints de NSCLC présentent des tumeurs avec mutations
activant l’EGFR, ce qui représente, selon les estimations, 33 000 cas chaque année en Europe.4-8
A propos d’Avastin
Suite à son homologation initiale aux Etats-Unis en 2004 pour le cancer colo-rectal avancé, Avastin est
devenu le premier anti-angiogénique mis à disposition à grande échelle pour le traitement de patients atteints
d’un cancer au stade avancé.
Aujourd’hui, Avastin continue de transformer la prise en charge des patients cancéreux grâce à son bénéfice
thérapeutique avéré en termes de survie (survie globale et/ou survie sans progression) lors de différents types
de tumeurs. Avastin est approuvé en Europe pour le traitement des stades avancés du cancer du sein, du
cancer colo-rectal, du cancer du poumon non à petites cellules, du cancer du rein, du cancer de l’ovaire et du
cancer du col de l’utérus; il est également disponible aux Etats-Unis pour le traitement du cancer colo-rectal,
du cancer du poumon non à petites cellules, du cancer du rein, du cancer du col de l’utérus et du cancer de
l’ovaire récidivant résistant au platine. Avastin est par ailleurs homologué dans plus de 70 autres pays pour le
traitement du glioblastome en progression à la suite d’un traitement précédent. Avastin est approuvé au
Japon pour le traitement des stades avancés du cancer colo-rectal, du cancer du poumon non à petites
cellules, du cancer du sein, du cancer de l’ovaire et des gliomes malins, y compris du glioblastome de
diagnostic récent.
Avastin a fait du traitement anti-angiogénique un pilier fondamental du traitement du cancer d’aujourd’hui.
A ce jour, plus de 2 millions de patients ont été traités par Avastin. Un vaste programme clinique englobant
plus de 300 études en cours examine l’utilisation d’Avastin dans plus de 50 types de tumeurs.
A propos de Tarceva

4
/
5
Tarceva est un médicament non chimiothérapique pris une fois par jour par voie orale et destiné au
traitement du NSCLC au stade avancé ou métastatique. Il s’est avéré inhiber le récepteur de l’EGFR, protéine
impliquée dans la croissance et le développement des cancers.
Tarceva est développé et commercialisé par Astellas Pharma US en partenariat avec Genentech aux Etats-
Unis, Chugai au Japon et Roche dans le reste du monde.
A propos de Roche
Roche est une entreprise internationale à l’avant-garde de la recherche et du développement de produits
pharmaceutiques et diagnostiques. L’amélioration de la qualité et de la durée de vie des patients, grâce aux
progrès de la science, est au cœur de ses préoccupations.
Roche est la plus grande entreprise de biotechnologie dans le monde avec des médicaments différenciés dans
les domaines de l’oncologie, de l’immunologie, des maladies infectieuses, de l’ophtalmologie et des affections
du système nerveux central. Roche est également le numéro un mondial du diagnostic in vitro ainsi que du
diagnostic histologique du cancer, et une entreprise de pointe dans la gestion du diabète. Rassemblant des
compétences pharmaceutiques et diagnostiques sous un même toit, Roche est le leader de la médecine
personnalisée, approche permettant de proposer le meilleur traitement possible à chaque patient.
Depuis sa fondation en 1896, Roche mène des recherches pour prévenir, identifier et traiter au mieux des
maladies, et apporter une contribution durable à la société. Vingt-neuf médicaments développés par Roche
font aujourd’hui partie de la Liste modèle de Médicaments Essentiels de l’Organisation Mondiale de la Santé,
notamment des antibiotiques, des traitements antipaludéens et des anticancéreux permettant de sauver des
vies. Pour la septième fois consécutive, dans le cadre des Dow Jones Sustainability Indexes, Roche a été
désignée entreprise la plus durable dans le secteur des produits pharmaceutiques, des biotechnologies et des
sciences de la vie.
Le groupe Roche, dont le siège est à Bâle, Suisse, opère dans plus de cent pays. En 2015, Roche comptait plus
de 91 700 employés dans le monde et a consacré 9,3 milliards de CHF à la recherche et au développement,
son chiffre d’affaires s’élevant à 48,1 milliards de CHF. Genentech, aux Etats-Unis, appartient entièrement au
groupe Roche, qui est par ailleurs l’actionnaire majoritaire de Chugai Pharmaceutical, Japon.
Pour de plus amples informations, veuillez consulter www.roche.com.
Tous les noms de marque mentionnés sont protégés par la loi.

5
/
5
Informations complémentaires
- Roche en oncologie: www.roche.com/media/media_backgrounder/media_oncology.htm
Relations avec les médias, groupe Roche
Téléphone: +41-61 688 8888 / e-mail: basel.mediaoffi[email protected]
- Nicolas Dunant (responsable du bureau des médias)
- Catherine Dürr
- Ulrike Engels-Lange
- Anja von Treskow
Références
1. Seto T et al. Lancet Oncol. 2014; 15(11): 1236-44
2. Herbst RS et al. Lan Oncol. 2011; 377(9780): 1846-54
3. Stahel RA et al. A phase II trial of erlotinib and bevacizumab (B) in patients with advanced non-small cell lung cancer with
activating epidermal growth factor receptor mutations with and without T790M mutation. ECC 2015 abstract #3BA.
4. European Cancer Observatory 2012. Estimated cancer incidence and mortality in European Union. Last accessed May 2016 at
http://eco.iarc.fr/eucan/Country.aspx?ISOCountryCd=930
5. National Comprehensive Cancer Network (NCCN) 2016. NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines).
Non-Small Cell Lung Cancer. Version 4.2016
6. Antonicelli A et al. Int J Med Sci 2013; 10(3): 320-30
7. American cancer society. Types of non-small cell lung cancer. Last accessed May 2016 at
http://www.cancer.org/cancer/lungcancer-non-smallcell/detailedguide/non-small-cell-lung-cancer-what-is-non-small-cell-lung-
cancer
8. Barzi and Pennell NA. ECJMO. 2010:2(1):31-42
9. GLOBOCAN 2012. Estimated cancer incidence, mortality and prevalence worldwide in 2012. Last accessed May 2016 at
http://globocan.iarc.fr/Pages/fact_sheets_population.aspx
10. American Cancer Society. The global economic cost of cancer (2010). Last accessed May 2016 at
http://www.cancer.org/acs/groups/content/@internationalaffairs/documents/document/acspc-026203.pdf
1
/
5
100%