Dosage spectrophotométrique des ions nitrate - Terminale S
Telechargé par
anwarbeg.hamad59410

Problème expérimental: Dosage spectrophotométrique des ions nitrate
d'une eau.
Doc 2 Protocole expérimental du dosage des ions nitrate dans une eau
A - Dans un ballon de 150 mL muni d'un réfrigérant à eau et placé sous une hotte,
on a introduit V0 = 5,0 mL d'eau polluée, une dizaine de copeaux de cuivre (200
mg environ) et 5 mL d'acide sulfurique concentré. Les ions nitrate sont le réactif
limitant. On a chauffé à 80°C pendant une heure. Après refroidissement, on a
filtré le contenu du ballon et on l'a transvasé dans un erlenmeyer maintenu dans
un bain eau-glace. On a versé, avec précaution, 25 mL environ d'une solution
d'ammoniac à 1mol.L-1. L'ammoniac est en excès. On a transféré le mélange dans
une fiole jaugée de 100 mL et on a complété avec de l'eau distillée.
On appelle Seau la solution bleue obtenue.
B - Dans une fiole jaugée de 50,0 mL, on a dissout 250 mg de sulfate de cuivre (II)
pentahydraté, CuSO4,5H2O(s), dans une solution d'ammoniac à 1 mol.L-1 notée S'
: on appelle S0 cette solution.
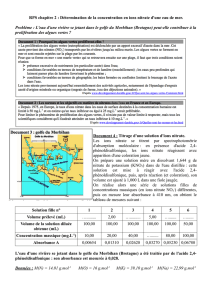
À partir de S0, réaliser dans des tubes à essais trois solutions filles notées S1, S2,
Doc 1 Art 1er. - Les limites et références de qualité des eaux destinées à la consommation
humaine, à l'exclusion des eaux conditionnées, sont définies enannexe I du présent arrêté.
Terminale S-Physique Chimie- Enseignement de spécialité LEH-M.------
Thème 1: l'eau domaine d'étude: eau et environnement
Mots-clés: mers, océans, climat, traceur chimique, érosion, dissolution, concrétion, surveillance
et lutte physico-chimique contre les pollutions, pluies acides

S3, telles que :
Si
S1
S2
S3
S0 (volume en mL
et prélevé à la
burette graduée)
7,5
5,0
2,5
S' (volume en mL
et prélevé à la
burette graduée)
2,5
5,0
7,5
C - Mesurer l'absorbance des solutions So, S1, S2 et S3 à 0 = 610 nm.
Si
S1
S1
S2
S3
absorbance A
Problème : L'eau est-elle Potable?
Doc 3 Lorsque l'on verse une solution d'ammoniac NH3(aq), dans
une solution contenant des ions Cu2+(aq), on observe que la
solution prend une coloration bleue intense due à la formation
d'un ion complexe de formule
Cu(NH
3
)
4
2
(aq)
, appelé ion
tétraamminecuivre (II).
Doc 4 Specre d'absorption d'une solution de
complexe tétraamminecuivre (II) de
concentration 20 mmol.L-1.
Doc 5
Données :
Couples oxydant/réducteur :
NO
3
(aq)/NO(g);Cu
2
(aq)/Cu(s)
1
/
2
100%