Développement et Enregistrement International des Médicaments

1
MENTION DE MASTER
« MEDICAMENTS ET AUTRES PRODUITS DE SANTE »
DEUXIEME ANNEE DE MASTER (M2)
Spécialité
« Développement et Enregistrement International des
Médicaments »
Enseignants responsables
Secrétariat de la scolarité
Conditions d’admission
Modalités d’inscription
Ce parcours est ouvert aux étudiants suivant
des études :
- pharmaceutiques et reçus en 5ème année,
- médicales, vétérinaires, agronomiques ou
scientifiques, titulaires d’un M1 ou
équivalent, notamment les titulaires d’un
diplôme d’ingénieur.
Dossier de candidature téléchargeable sur le site
http://www.u-psud.fr
ou auprès du service de la scolarité
à renvoyer avant le 15 mai
Faculté de Pharmacie
Service de Scolarité
5, rue Jean-Baptiste Clément
92 296 Châtenay-Malabry Cedex
Objectifs
Former des professionnels du médicament par un enseignement approfondi des aspects
scientifiques et réglementaires du développement pré- et post-AMM et de l’enregistrement des
médicaments, tant sur les aspects stratégiques qu’opérationnels, dans une dimension
internationale visant : Union Européenne, Etats-Unis d’Amérique, Canada, Japon, Afrique du
Sud, Amérique Latine (Argentine, Brésil, Mexique, Colombie…), Asie du Sud-Est (Chine,
Corée, Inde...), Australie, Europe Centrale et Orientale, Inde, Maghreb, Turquie, Pays du Golfe,
Suisse…
Débouchés
Au sein des entreprises du médicament, des sociétés de service spécialisées dans les dossiers
réglementaires ou des agences nationales et internationales des produits de santé à usage humain
ou vétérinaire, notamment dans les départements suivants :
affaires réglementaires pré- et post-AMM : dossiers d’AMM, dossiers de remboursement
et de prix, extension d’indications, variations, renouvellement d’AMM, stratégie et
modalités d’enregistrement, suivi des affaires biomédicales, mise à jour des RCP,
demandes informations, veille réglementaire et concurrentielle, maintien de
l’enregistrement des produits sur les marchés, maintien des licences, etc…
aspects réglementaires du développement non-clinique et clinique des médicaments
pharmacovigilance et gestion du risque
contrôle de la visite médicale et de la publicité

2
CONSTRUCTION DU PARCOURS ET ORGANISATION DE LA FORMATION
Le parcours comprend 6 UE obligatoires.
Les enseignements, en français ou en anglais, s’appuieront sur des cours, conférences,
visioconférences et tables rondes par des professionnels du développement, de
l’enregistrement et de la réglementation des médicaments et appartenant à l’industrie
pharmaceutique, aux Agences nationales/internationales du médicament ou aux sociétés
de consultants, ainsi que sur des études de dossiers et sur la réalisation et la présentation
de projets de groupes ou individuels.
A la suite du stage de 6 mois en situation professionnelle, un rapport, rédigé et exposé
devant les professionnels, présentera les missions réalisées au cours du stage.
Pour les étudiants en pharmacie, un rapport sur un sujet d’actualité dans les domaines du
développement et de l’enregistrement pourra déboucher sur la thèse de diplôme de
docteur en pharmacie.
Les enseignants responsables du parcours ont un rôle actif auprès des étudiants :
• dans la recherche et le choix de leur stage dès le début des enseignements :
rédaction des CV et de lettres de motivation en français et en anglais ;
organisation sur place d’entretiens individuels avec les entreprises
pharmaceutiques désirant accueillir nos stagiaires pour des missions bien définies
en France, en Europe ou hors Europe, avec la possibilité de contrat V.I.E.
(volontariat international en entreprise) pour 12 à 18 mois (Afrique du Sud,
Argentine, Australie, Brésil, Canada, Etats-Unis, Russie…)
• dans leur insertion professionnelle après l’obtention du diplôme, en partenariat
direct avec les entreprises du médicament et avec des cabinets de consultants.
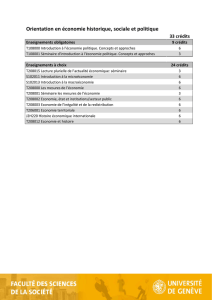
INTITULE DES UNITES D’ENSEIGNEMENT ET NOMBRE DE CREDITS EUROPEENS
(TOTAL DE 60 CREDITS)
1er semestre
Contenu scientifique du dossier d'AMM..……………………………………….10 crédits
Développement et enregistrement des médicaments dans l’Union Européenne….5 crédits
Développement et enregistrement des médicaments hors Union Européenne........5 crédits
Développement et enregistrement des produits issus des biotechnologies………..4 crédits
Activités péri- et post-AMM………………………………………………………2 crédits
Réalisation d’un projet de développement d’un médicament……………………..4 crédits
2ème semestre
Stage de 6 mois…………..……………………………….……………………..30 crédits
en entreprise pharmaceutique, organisme réglementaire, agence de développement ou
société de consultants partenaires de l’industrie pharmaceutique, en France, en Europe ou
hors Europe.
1
/
2
100%