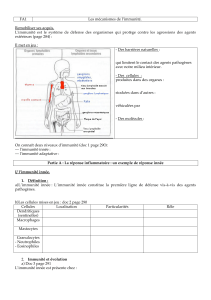
L immunité innée : la face cachée de l`immunopathologie sous les

L’
actualité est riche, avec la découverte de nombreuses
nouvelles pièces du grand puzzle de l’immunopatho-
logie. La compréhension du rôle de l’immunité innée
a constitué une avancée majeure pour mieux comprendre les affec-
tions inflammatoires chroniques.
Cette immunité, qui est la première barrière de notre organisme
(en dehors des barrières mécaniques), joue aussi un rôle fonda-
mental dans la régulation de l’immunité acquise (ou adaptative),
qui comprend les défenses cellulaires et humorales (anticorps).
Cette immunité est régulée par des mécanismes complexes dont
le dysfonctionnement provoque des maladies inflammatoires
chroniques (1).
L’immunité innée établit des relations
avec notre environnement microbien pour nous défendre,
mais aussi pour réguler différents mécanismes
physiologiques immunitaires
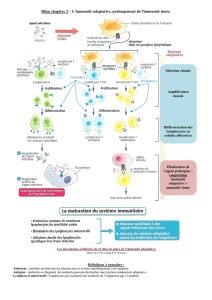
Cette immunité comprend plusieurs mécanismes de défense met-
tant en jeu des cellules (macrophages, monocytes, polynucléaires,
mastocytes, cellules dendritiques et diverses cellules résidentes)
et des médiateurs solubles (cytokines, chémokines, facteurs de
croissance, complément, protéines antibactériennes). Ce système
a pour objectif principal d’éliminer l’agresseur potentiel, mais aussi
de réguler différents mécanismes physiologiques. Schématique-
ment, l’immunité innée est fondée sur l’interaction entre des agents
ou des débris microbiens appelés PAMP (pathogene associated
molecular patterns) et des récepteurs présents à la surface de nom-
breuses cellules de l’immunité innée, les PRR (pattern recognizing
receptors)(figure). Parmi ces récepteurs, la famille des récepteurs
toll-like (TLR) semble particulièrement importante, car elle per-
met la synthèse de molécules indispensables à la survie, comme
les cytokines, les chémokines, les enzymes.
●
●L’orchestration de toutes ces réactions et leur interaction avec
l’immunité acquise sont à l’origine de nombreux travaux. L’une
des découvertes les plus intéressantes est celle de la présence des
récepteurs de l’immunité innée (les TLR) sur les lymphocytes B.
De façon plus précise, il a été démontré dans un modèle murin
(souris MRL/lupus) que les lymphocytes B autoréactifs produisent
des auto-anticorps (facteurs rhumatoïdes) s’ils sont stimulés par
des immuns complexes (nucléosomes-antinucléosomes) qui se
fixent sur les récepteurs BCR (récepteurs de l’antigène des lym-
phocytes B), mais aussi s’ils sont costimulés par des débris bacté-
riens (ADN hypométhylé avec des motifs CPG) qui se fixent sur
des récepteurs TLR9. Il est d’ailleurs intéressant d’observer que
l’hydroxychloroquine, utilisée dans de nombreuses maladies
auto-immunes, est un inhibiteur du TLR9 (2, 3).
●
●La symbiose entre l’homme et l’environnement s’explique par
l’interface qui s’établit grâce à l’immunité innée. Il s’agit d’un phé-
nomène fondamental qui existe dans le monde vivant, des insectes
aux mammifères. Le rôle de cette immunité innée est d’abord de
L’immunité innée : la face cachée de l’immunopathologie
sous les feux des projecteurs
Première partie : immunité innée et environnement microbien
Inate immunity under the highlights:
the role of the microbial environment
© La Lettre du Rhumatologue 2005;315(Suppl.):5-6.
●
J. Sibilia*
*Service de rhumatologie, CHU de Strasbourg.
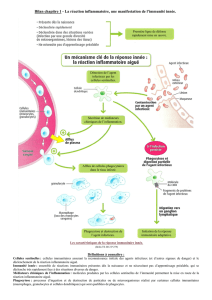
Figure. Schéma de l’immunité innée. L’immunité innée est la conséquence
d’interactions entre les PAMP bactériens et les récepteurs PRR présents
sur de nombreuses cellules de l’immunité innée.
Une avancée fondamentale : la découverte de l’immunité innée !
Environnement
Microbes
PPRs
MAPK
MBL R
TLR
PAMP
α/ß
Microbes C1q
Mannose
MBL
Activation
complément
CR
NF-κß
Activation/Inhibition
Apoptose
Rôle dans les maladies inflammatoires ?
MISE AU POINT
8
La Lettre du Pneumologue - Volume IX - no1 - janvier-février 2006

9
La Lettre du Pneumologue - Volume IX - no1 - janvier-février 2006
nous défendre en éliminant l’agresseur, mais elle a aussi de nom-
breuses autres actions, dont certaines nous sont bénéfiques.
✓L’observation, issue d’un travail récent, d’une symbiose entre
une bactérie et un petit calamar hawaïen est instructive. Euprymna
scolopes est un petit céphalopode hawaïen dont les nouveau-nés
ne peuvent se développer que s’ils sont “contaminés” par une bac-
térie (Vibrio fischeri) présente dans l’eau de mer. Cette bactérie
qui infecte les hémocytes de ces petits calamars va permettre leur
morphogenèse en induisant la régression de cellules épithéliales
de structure appelées chromatophores. Cette “toxicité” épithéliale
s’explique par différents mécanismes : induction d’apoptose, libé-
ration de NO et de cytokines et inhibition de la synthèse d’ADN.
Ces phénomènes sont induits par une toxine qui est un monomère
de peptidoglycanes appelés TCT (tracheal cytotoxine). Il est inté-
ressant d’observer que cette TCT est analogue à celle impliquée
dans les infections humaines à Bordetella pertussis et Neisseria
gonorrhoae. Dans ces deux maladies, elle agit presque de la
même façon, en entraînant une mort des cellules épithéliales de
la trachée (coqueluche) et des trompes (stérilité tubaire) (4).
✓Chez l’homme, le monde microbien a aussi des effets positifs.
L’exemple le plus spectaculaire est certainement la découverte
du rôle bénéfique de certains constituants bactériens dans la mala-
die de Crohn (MC).
La MC, qui a été découverte en 1913, semble avoir une incidence
de plus en plus élevée dans les pays occidentaux. Cela pourrait
être lié au mode de vie, en particulier à l’hygiène domestique ou
à l’intervention de facteurs environnementaux.
L’épidémiologie de la MC suggère une hypothèse pathogénique
originale. Cette maladie serait apparue avec le développement du
frigidaire ! En effet, des bactéries psychotrophiques (c’est-à-dire
capables de croître à une température de – 1 à + 10 °C) pourraient
avoir un rôle dans la pathogénie de la MC. Parmi ces bactéries,
Yersinia enterocolitica, Yersinia pseudotuberculosis, Listeria
monocytogenes et certaines mycobactéries sont de bons candi-
dats (5). Cependant, l’histoire de la pathogénie de la MC vient de
rebondir grâce à une découverte fondamentale qui permet de mieux
la comprendre. Les macrophages, et certainement d’autres cellules
présentatrices de l’antigène, possèdent des récepteurs susceptibles
d’être activés par des débris bactériens (PAMP). Ces récepteurs
sont des TLR (notamment TLR2), qui sont stimulables en particu-
lier par le peptidoglycane bactérien. Cette activation entraîne une
intense réponse pro-inflammatoire macrophagique, laquelle va
se traduire par la synthèse de grandes quantités d’interleukine 12
entraînant la prolifération de lymphocytes T CD4 Th1. Ce système
pro-inflammatoire est normalement régulé par une deuxième voie,
découverte très récemment. Il s’agit de la voie NOD2/CARD15,
qui est capable d’inhiber l’activation de la voie de NF-kB induite
par la stimulation du récepteur TLR2. L’un des éléments les plus
étonnants est que cette voie NOD2 est également activable par des
PAMP bactériens, en particulier par le muramyl dipeptide. Ainsi,
en cas d’infection bactérienne, les PAMP sont capables d’activer
les macrophages intestinaux, mais aussi de contrôler leur compor-
tement inflammatoire via la voie NOD2/CARD15 (6).
Quelle est l’importance de ce système dans la maladie de Crohn ?
Il a été découvert, avec une certaine surprise, que près de 40 % des
MC avaient une mutation du gène NOD2/ CARD15, ce qui entraîne
un défaut de fonctionnement de cette voie inhibitrice. En consé-
quence, toute stimulation microbienne des macrophages intesti-
naux peut provoquer une intense inflammation intestinale qui ne
sera pas contrôlée. Il est possible que ces mutations aient été
acquises assez récemment dans l’histoire humaine, peut-être lors
des grandes épidémies de peste du Moyen Âge. Sous la “pression”
de cette infection, qui a sévi de façon endémique pendant des cen-
taines d’années, sont apparus des sujets “mutants” capables d’éli-
miner les bactéries. Ainsi, les mutations de NOD2/CARD15 pour-
raient représenter un avantage par leur capacité à développer une
inflammation intestinale (qui ne peut être inhibée) fortement anti-
microbienne. Ce n’est qu’une hypothèse, mais elle est intéressante !
Ainsi, la pathogénie de la MC semble en partie décryptée…
Cependant, il reste des interrogations. D’une part, toutes les MC
n’ont pas ces mutations et, d’autre part, il existe d’autres maladies,
en particulier le syndrome de Blau qui se caractérise également
par des anomalies de NOD2/CARD15. Cette découverte fonda-
mentale illustre l’originalité d’un nouveau groupe de maladies
appelées “auto-inflammatoires”, qui se définit par un dérèglement
d’origine génétique de la cascade de l’inflammation.
●
●La prise de conscience du rôle bénéfique d’éléments micro-
biens est à l’origine de l’émergence d’une théorie dite “hygiéniste”
de l’auto-immunité. En effet, l’observation d’une plus grande préva-
lence des maladies auto-immunes dans les pays occidentaux a per-
mis de suggérer que la réduction de la pression de l’environnement
microbien (liée à l’éloignement de l’homme de son élément natu-
rel) pourrait influencer l’éducation du système immunitaire. Moins
de pression microbienne pourrait faciliter l’émergence de phéno-
mènes d’auto-immunisation. Cette théorie a également été évoquée
pour expliquer l’augmentation des maladies allergiques (7).
■
La deuxième partie (“Le rôle de la cellule dendritique”) sera traitée
dans le prochain numéro.
RÉFÉRENCES BIBLIOGRAPHIQUES
1.Sibilia J. Novel concepts and treatments for autoimmune disease: ten focal
points. Joint Bone Spine 2004;71:511-7.
2.Leadbetter EA, Rifkin IR, Marshak-Rothstein A. Toll-Like receptors and
activation of autoreactive B cells. Curr Dir Autoimmun 2003;6:105-22.
3.Leadbetter EA, Rifkin IR, Hohlbaum AH et al. Immune complexes activate
autoreactive B cells by co-engagement of S Ig M and toll-Like receptors.
Nature 2002;416:603-7.
4.Koropatnick TA, Engle JT, Apicella MA et al. Microbial factor-mediated
development in a host-bacterial mutualism. Science 2004;306:1186-8.
5.Hugot JP, Alberti C, Berrebi D et al. Crohn’s disease: the cold chain hypo-
thesis. Lancet 2003;13(362):2012-5.
6.Watanabe T, Kitani A, Murray PJ, Strober W. NOD2 is a negative regulator
of toll-like receptor 2-mediated T helper type 1 responses. Nat Immunol 2004;
5:800-8.
7. Bach JF. The effect of infections on susceptibility to autoimmune and allergic
diseases. N Engl J Med 2002;347:911-20.
1
/
2
100%