SYNTHESE

SYNTHESE
Une craniosynostose est une pathologie caractérisée par la fusion prématurée d'une ou
plusieurs sutures crâniennes. C'est un défaut de naissance assez fréquent (1/2500
naissances) qui résulte en une forme anormale du crâne et qui peut être accompagné
d'une déficience mentale dans certains cas (Wilkie, 1997; Wilkie and Morriss-Kay,
2001). Les craniosynostoses peuvent être syndromiques ou asyndromiques, et elles
sont dues à la mutation d'un ou plusieurs gènes. Les mécanismes impliqués dans les
craniosynostoses sont toujours peu connus. Cependant, il est important de déterminer
leur cause génétique afin que chaque patient ai un un pronostic de chirurgie adapté a
l'origine génique de sa synostose. En effet, l'aboutissement n'est pas le même selon
l'étiologie de la synostose, et une origine monogénique possède beaucoup plus de
complications qu'une origine multigénique (Seto et al., 2007), comme par exemple une
pression intracrânienne élevée et des altérations de la vision, de l'ouïe, la respiration, la
dentition, la parole ainsi que du développement neurocognitif (Wilkie and Morriss-Kay,
2001).
Le syndrome de Saethre-Chotzen est caractérisé par la fusion prématurée de la suture
coronale (séparant l'os frontal et l'os pariétal), ainsi que par un dysmorphisme facial
et/ou la fusion de plusieurs doigts ou orteils (ref El Gouzzhi et al., 1997; Kress et al.,
2006; Howard et al., 1997). Il est le trouble autosomique dominant le plus fréquent avec
1 naissance sur 25 000, et est causé par des mutations perte-de-fonction (missense,
duplication, délétion, nonsense) du gene TWIST1 (El Ghouzzi et al. 1997; Howard et al.
1997) qui encode un facteur de transcription basique Helix-Loop-Helix (bHLH) de classe
II.
Nos collaborateurs Dr Andrew Wilkie et son équipe ont réalisé des analyses de variants
et des séquençages d'exome sur des patients atteints du syndrome de Saethre-Chotzen
ou de coronal synostose dont l'analyse génétique était négative quant à la mutation de
Twist1 et des gènes responsables de synostoses. Ils ont alors identifié des mutations
pathologiques présentes dans un nouveau gène: transcription factor 12, ou TCF12
(Sharma, Fenwick, Brockop, et al., 2013).
Il a ainsi été démontré que le gène TCF12, qui encode un facteur de transcription bHLH
de classe I, est la cause des synostoses coronales asyndromiques et syndromiques
telle que le syndrome de Saethre-Chotzen. Cela nous prouve que TCF12 est un gène
important pour le développement de la suture coronale (Sharma, Fenwick, Brockop, et
al., 2013) (Figure 1).

"!
Nous nous sommes tournés vers le modèle de la souris, qui nous a permis jusqu'à
présent d'étudier le syndrome Saethre-Chotzen grâce au mutant hétérozygote Twist1
(Chen and Behringer, 1995). Comme l'humain, ce mutant implique une mutation perte-
de-fonction du gène Twist1, et il présente un phénotype de synostose coronale
ressemblant à celui qui est observé chez les patients atteints du syndrome de Saethre-
Chotzen.
Figure 1
TCF12, nouveau gène découvert en cause de coronale synostosis asyndromique ainsi que du
syndrome Saethre-Chotzen
(Sharma, Fenwick, Brockop, et al., 2013
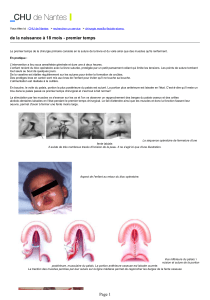
Figure 2
Etude de la suture coronale à la naissance des souris sauvages (WT), EIIa-Cre;Tcf12flox+/-,
Twist1+/- , and EIIa-Cre;Tcf12floxflox
les flèches indiquent la fusion de la suture. PB; Parietal bone. FB: frontal bone. cs: coronal
suture. ms: metopic suture. ss: sagittal suture

!
3!
Apres nous être procurés une souris possédant une mutation perte-de-fonction de
TCF12, nous avons pu déterminer que chez la souris, comme chez l'homme, Tcf12 joue
un rôle dans le développement de la suture coronale (Sharma, Fenwick, Brockop, et al.,
2013). Cependant, la souris est moins sensible au dosage de la réduction de
l'expression de Tcf12. En effet, si les souris possédant une perte de fonction
homozygote de Tcf12 présentent de faibles fusions sporadiques de la suture coronale,
les souris hétérozygotes, elles, n'ont pas de craniosynostose (Figure 2).
De plus, en croisant les mutants hétérozygotes perte-de-fonction Twist1, et Tcf12, nous
démontrons qu'une réduction de l'expression génique de Twist1 et Tcf12 chez la souris
cause une synostose coronale extrêmement sévère, bien plus sévère que le phénotype
observé chez les souris Twist+/-simples (Figure 3).
Ces résultats suggèrent une interaction génétique entre Twist1 et Tcf12 quant au
développement de la suture coronale (Sharma, Fenwick, Brockop, et al., 2013).
!
Figure 3
Etude de la suture coronale chez les souris sauvages (WT), simples EIIa-Cre;Tcf12flox+/- et
Twist1+/- , et doubles mutants EIIa-Cre;Tcf12flox+/-;Twist1+/- au stade P21
Alizarin Red S (A-D) et micro-CT ont été réalisés 21 jours post-natal (P21) ( E-L). les flèches
indiquent la fusion de la suture. les petits traits représentent la vue de la section sagittale du
crâne vue en (I-L). PB; Parietal bone. FB: frontal bone. CS: coronal suture. L: lambdoid suture.
M: metopic suture. SS: sagittal suture. (Sharma, Fenwick, Brockop et al., 2013)

!
4!
Figure 4
hybridation in situ de TCF12 au niveau de la suture coronale d'un embryon sauvage au stade
E14.5
A: coloration ALP. B: hybridation in situ du mRNA de Tcf12 montrant le patron d'expression du
gène TCF12. C: cartilage, CA: coronal suture, D: dura, EL: ectocranial layer, FB: frontal bone,
PB: parietal bone.
Figure 5
patron d'expression des protéines Tcf12 et Twist1 dans la suture
observation de la localisation des protéines Tcf12 et Twist1 dans la suture coronale.
PB;Parietal bone. FB: frontal bone. cs: coronal suture
Il est de fait connu que les bHLH de types I tendent a former des dimères avec les bHLH
de class II (Lassar et al., 1991; Murre et al., 1989), et il a été précédemment rapporté
que Tcf12 hétérodimérise avec Twist1 (Connerney et al, 2006). Cela nous permet
d'émettre l'hypothèse qu'une dimérisation entre Twist1 et Tcf12 se produit lors de la
formation de la suture coronale, et que le dosage des hétérodimères Twist1/Tcf12 est

!
5!
crucial pour le développement de la suture coronale (Sharma, Fenwick, Brockop, et al.,
2013).
Cette hypothèse est consistante avec les patrons d'expression des gènes Tcf12 et
Twist1, ainsi que les patrons d'expression de leurs protéines. En effet, lors du
développement de la suture coronale, les gènes Tcf12 (Figure 4) et Twist1 (Yen et al.,
2010) sont exprimés dans la suture coronale, de même que les protéines Twist1 et
Tcf12 (Figure 5).
Afin d'approfondir le rôle de Twist1/Tcf12 dans le développement de la suture coronale,
nous avons examiné les marqueurs des voies de signalisation Notch et Ephrin-Eph dans
lesquelles Twist1 est impliqué, à la fois chez les souris sauvages, les simple mutants
hétérozygotes pour Twist1 ou Tcf12, et les doubles mutants hétérozygotes. Nous avons
pu ainsi déterminer que Tcf12/Twist1 fonctionne de manière similaire à Twist1, en
empruntant les même voies de signalisations et en ayant les même effets sur leurs
cibles. Ces résultats concordent avec notre hypothèse suggérant une fonction
coopérative de Twist1 et Tcf12 dans le développement de la suture coronale (Figures 6
et 7).
Nous nous sommes aussi penchés sur Twist1 seul.
Nous avons tout d'abord cherché a confirmer la relation entre Twist1 et Notch2 dans la
suture coronale en réalisant un croisement entre Twist1 et un mutant possédant une
diminution de fonction du gène Notch2 spécifiquement dans le mésoderme. En effet, la
suture coronale, de même que l'os pariétal, est dérivée du mésoderme, contrairement a
l'os frontal qui a pour origine la crête neurale. Nous avons observé un sauvetage du
phénotype de fusion de la suture coronale présent lors d'une réduction de l'expression
de Twist1, lorsqu'on ajoute une diminution de l'expression de Notch2 (Figure 8).
Cela est consistant avec des précédentes données obtenue par notre groupe (Yen et
al., 2010) et nous permet de noter que lors du développement de la suture coronale,
Twist1 exclut Notch2 de la suture coronale, afin de la garder ouverte.
Nous avons aussi observé le rôle que beta-caténine joue lors du développement de la
suture coronale. Après avoir réalisé un croisement entre Twist1 et un mutant possédant
une diminution de fonction du gène Beta-caténine spécifiquement dans le mésoderme,
nous avons assisté à une amplification du phénotype de fusion présent chez le mutant
Twist1+/- simple.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
1
/
11
100%