Chapitre 9 : Chaînes carbonées I – Squelette

Chapitre 9 : Chaînes carbonées
I – Squelette carboné
1. Forme d’une molécule organique
Une molécule organique est constituée d’atomes de carbones liés par des liaisons simples,
doubles, ou triples, formant des chaînes linéaires, ramifiées, ou cycliques. Cette structure est
le squelette carboné, portant les hydrogènes et autres groupes d’atomes.
2. Ecriture topologique
Une molécule est représentée par les liaisons entres carbones et les atomes différents de H et
C. Une chaîne linéaire est représentée par une ligne brisée. Les autres éléments ou groupes
d’atomes sont représentés normalement.
3. Isomère de constitution
Deux isomères de constitution diffèrent par l’enchaînement de leurs atomes.
Isomères de chaîne (C) : la chaîne est différente.
Isomères de position (P) : un groupe où une liaison a une position différente.
Isomères de fonction (F) : le groupe de caractéristique est différent.
II – Hydrocarbures saturés
1. Alcanes
Ce sont des hydrocarbures à chaînes linéaires saturées.
Formule des alcanes : CnH2 x n + 2
H H H H H
| | | | |
H – C – C – C – C … C - H
| | | | |
H H H H H
Les atomes de cette chaîne non cyclique sont liés à quatre atomes : ils sont tétragonaux.

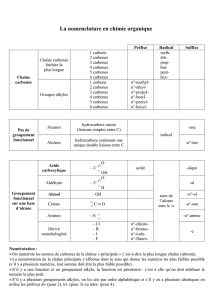
2. Nomenclature
Chaîne linéaire :
Le nom de la chaîne linéaire est constitué d’un préfixe indiquant le nombre de carbone et de la
terminaison « ane » pour alcane. On a ainsi :
1 carbone → méthane
2 carbones → éthane
3 carbones → propane
4 carbones → butane
… avec les origines grecs pour la suite (pentane, octane, décane et autres).
Groupe alkyle :
Un groupe alkyle est obtenu en ôtant un hydrogène d’un alcane. Son nom est obtenu en
remplaçant la terminaison « ane » par « yle ». On a ainsi :
1 carbone → méthyle
2 carbones → éthyle
3 carbones → propyle
4 carbones → butyle
… avec les origines grecs pour la suite (pentyle, octyle, décyle et autres).
Chaîne ramifiée :
Le nom de la molécule est celui de la chaîne la plus longue précédée des nombres, noms, et
positions de chaque type de ramifications.
triméthyle – 2- 4 – 8 – diéthyle – 3 – 6 – décane
3. Cyclanes
Les cyclanes forment des chaînes fermées d’hydrocarbures saturés.
III – Hydrocarbures insaturés
1. Alcènes et dérivés éthyléniques
Les alcènes sont des hydrocarbures non cycliques possédant une double liaison entre deux
carbones.
Formule des alcènes : CnH2 x n
H H H H H H H
| | | | | | |
H – C – C – C – C … - C = C - … C - H
| | | | |
H H H H H
Les dérivés éthyléniques portent une ou plusieurs doubles liaisons entre deux carbones.

2. Nomenclature
Le nom de la molécule est celui de la chaîne la plus longue portant la double liaison. Il est
défini par le préfixe donnant le nombre de carbones et le suffixe « éne » pour alcène. On
précise la position du carbone portant la double liaison. La description des ramifications est la
même que pour les alcanes.
3. Isomères Z, E
L’isomérie Z, E apparaît quand les carbones doublement liées portent chacun deux groupe
différents.
Forme Z Forme E
La forme Z est celle où les deux groupes les plus lourds sont du même côté que la double
liaison.
IV – Effet de la longueur des chaînes
1. Propriétés physiques
La densité augmente avec la longueur de la chaîne. Le plus souvent, la densité est supérieure à
1. Les hydrocarbures sont insolubles. La solubilité diminue quand la longueur de la chaîne
augmente. Les températures de changement d’état des composés d’une famille augmentent
avec la longueur de la chaise.
2. Application
Les différences de températures d’ébullition permettent de séparer les hydrocarbures par
distillation fractionnée.
1
/
3
100%