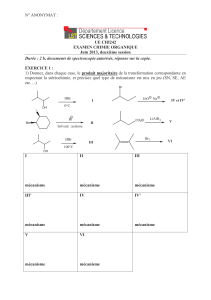
UE CHI242 EXAMEN CHIMIE ORGANIQUE Juin 2013, deuxième

UE CHI242
EXAMEN CHIMIE ORGANIQUE
Juin 2013, deuxième session
Durée : 2 h, documents de spectroscopie autorisés, réponse sur la copie.
Correction sur 42 points
EXERCICE 1 : (14 points)
1) Donnez, dans chaque case, le produit majoritaire de la transformation correspondante en
respectant la stéréochimie.
HBr
0°C
Br
HBr
I
II
III
IV et IV'
V
VI
LiAlH
4
I
Me
OH
OH 100°C
EtO Na
Br
CO
2
Et
Br
2
Solvant :acétone
I
B
r
(1)
SN1 (0,5)
II
Br
Me
(1)
SN2 (0,5)
III
(1)
E (0,5)
III
(1)
E (0,5)
IV
(1)
E (0,5)
IV’
(1)
E (0,5)
V
CH
2
OH
(1)
AN (0,5)
VI
Br
B
r
(1)
AE (0,5

2) Expliquez pour quelle raison le ,3-méthyl butan-2-ol conduit soit au composé I soit au
composé III en présence de HBr selon les conditions de température. (2)
Les réactions de substitution nucléophile et d’élimination sont en compétition. Lorsqu’on
chauffe pour des raisons thermodynamiques et plus particulièrement pour des raisons
entropiques la réaction d’élimination est favorisée par rapport à celle de substitution.
EXERCICE 2 : (12 points)
1) On envisage la chloration du benzène écrire le mécanisme de la réaction ci-dessous :
(1 + 2)
AlCl
3
Cl
Cl
+Cl
+
+ AlCl
4-
Cl
+
Cl
HCl
+ H
+
+
2) Soit l’iodobenzène et le benzaldéhyde :
I C
O H
Ecrire pour les deux molécules toutes les formules limites :
Structures limites de l’iodobenzène (2)
IIII
Structures limites du benzaldéhyde(2)

CHO O H HO
O H
3)
Déduire de la question précédente les produits obtenus lorsque ces deux
composés seront mis en réaction avec Cl
2
/AlCl
3
, justifier votre réponse :
Structure des produits obtenus Justification
Iodobenzène
I
Cl
I
Cl
(2)
Ortho/para directeur car ces
deux carbones sont plus
nucléophiles que le méta
(1)
Benzaldéhyde
CHO
Cl
(1)
méta directeur car ces deux
carbones sont plus
nucléophiles que l’ortho et
para
(1)
EXERCICE 3 :
(5 points)
Soit le sucre suivant :
O
OH
OHHO
OH
OH

Sur compléter les dessins suivant qui représente les deux conformations chaises de cette
molécule :
(2 x 2)
O
H
HO
H
HO
OH
H
H
HOH
OH
R
O
OH
OH
OH
H
H
HH
OH
HO
H
1)
Laquelle de ces deux conformation est la plus stable et pourquoi ?
(1)
Cette conformation est très privilégiée car la plupart des groupements sont en
position équatoriales ce qui minimise les interactions stériques 1,3-diaxiales.
EXERCICE 4 :
(11 points)
Soit le composé de formule brute C
4
H
10
O :
1)
Quel est l’indice d’insaturation correspondant à la formule brute de ce composé ?
(0,5)
II = 0
2)
Quelles sont les fonctions susceptibles d’être présentes dans cette molécule ?
(2 x 0,5)
Alcool et ether
3)
Interpréter les spectres IR, RMN
1
H et RMN
13
C et donner la formule développée
du composé correspondant.
Spectre infrarouge :
Interprétation :
(0,5)
Bande large au dessus de 3000 cm
-1
= alcool
(0,5)
Bandes en dessous de 3000
-1
= C-H
(0,5)
Bande C-O
Spectre RMN
13
C :

01020304050607080
PPM
q
dt
Interprétation :
(0,5)
Q = CH
3
(0,5)
D = CH
(0,5)
T = CH
2
(0,5)
Moins de signaux que de carbones donc symétrie dans la molécule
Spectre RMN
1
H :
I = 6
I = 2
I = 1
I = 1
Interprétation :
(2 x 0,5 : déplacement et couplage)
0,9ppm : 2 CH
3
couplés avec un H de CH
(2 x 0,5 : déplacement et couplage)
1,7 ppm : 1 CH multiplet
(2 x 0,5 : déplacement et couplage)
2 ppm : 1 de OH
 6
6
1
/
6
100%