La consultation d`oncologie génétique : qui, pourquoi, comment ?

Comment prendre en compte le risque génétique ?
La consultation d’oncologie génétique :
qui, pourquoi, comment ?
Cancer genetics clinics: what for?
Mots-clés : Oncogénétique – BRCA1/2 – Cancer du sein – Cancer de l’ovaire –
Dépistage – Chirurgie prophylactique.
Keywords: Cancer genetics clinics – BRCA1/2 – Breast cancer – Ovary cancer –
Screening – Prophylactic surgery.
C. Noguès*
Tenir compte de l’histoire familiale des cancers pour estimer le risque pour
une femme de développer un cancer du sein n’est pas toujours aisé. Certaines
histoires familiales sont dues à l’existence d’une anomalie génétique consti-
tutionnelle prédisposant au cancer du sein (dite majeure). Néanmoins agrégation
familiale et prédisposition génétique héritée ne sont pas synonymes. Lorsqu’il s’agit
de pathologies aussi fréquentes que le cancer du sein et, dans une moindre mesure,
de l’ovaire (respectivement près de 50 000 et 4 400 nouveaux cas par an en France),
il peut s’agir d’une accumulation fortuite de cas de cancers, de l’existence de facteurs
environnementaux ou de facteurs génétiques mineurs (susceptibilité).
On considère qu’environ 5 % des cancers du sein et de l’ovaire se développent
chez des personnes ayant une prédisposition génétique de transmission autosomique
dominante (d’origine aussi bien maternelle que paternelle).
L’orientation vers une consultation d’oncogénétique se fait devant une histoire
individuelle ou familiale inhabituelle, afin d’évaluer la probabilité de l’existence d’une
prédisposition héréditaire que les tests génétiques peuvent permettre d’objectiver et,
d’autre part, afin d’évaluer les risques de cancer et d’adapter la prise en charge.
* Service d’épidémiologie clinique, oncogénétique, Inserm U735, centre René-Huguenin,
Saint-Cloud.
30es journées de la SFSPM, La Baule, novembre 2008 183

État des lieux
Le syndrome sein-ovaire (BRCA1/2)
Il y a une dizaine d’années, l’identification des gènes BRCA1 et BRCA2, res-
pectivement situés sur les chromosomes 17(q21) et 13(q12-13) et codant pour des
protéines impliquées dans la réparation des lésions de l’ADN, a constitué une
avancée majeure. La recherche de mutation constitutionnelle (MC) de BRCA1/2 est
maintenant de pratique médicale courante (dans le cadre d’un dispositif légal bien
codifié).
Les risques principaux de cancers associés à une MC de BRCA1/2 concernent la
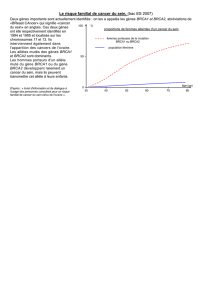
survenue d’un cancer du sein et/ou des ovaires [1-4]. Les estimations du risque cumulé
(pénétrance) de cancer pour les femmes ayant une MC de BRCA1/2 sont de l’ordre
de 40 à 85 % de développer un cancer du sein à 70 ans pour BRCA1 et BRCA2 contre
8 % dans la population générale, et de 20 à 60 % pour le cancer de l’ovaire pour
BRCA1 et de 6 à 27 % pour BRCA2 contre 1 % dans la population générale. Le risque
ovarien lié à BRCA1 est nettement plus élevé avant 50 ans que celui associé à BRCA2.
Le risque de développer un cancer du sein précocement (avant l’âge de 45 ans) est
de 25 % en cas d’implication du gène BRCA1, et de 7 % pour le gène BRCA2.
Il n’est pas possible aujourd’hui d’établir de lien entre telle mutation et la survenue
de tel type de cancer (sein, ovaire...), ni d’estimer les risques en fonction de la lourdeur
de l’histoire familiale, notamment par rapport à l’âge de survenue.
Le risque relatif d’autres cancers que ceux du sein et de l’ovaire est faible, hormis
le cancer de la trompe. Il est très probable qu’il existe un excès modéré de risque de
cancer de la prostate chez les hommes porteurs d’une mutation. Par ailleurs, pour
un homme porteur d’une mutation BRCA2, le risque cumulé de cancer du sein à
70 ans a été estimé à 5 %.
Les MC BRCA1 et BRCA2 n’expliquent pas l’ensemble des familles où une pré-
disposition au cancer du sein et de l’ovaire est évoquée. Il doit donc exister d’autres
gènes majeurs responsables des cas familiaux, mais, en dépit de nombreuses recher-
ches, ils n’ont pas encore été identifiés, sans doute en raison de l’hétérogénéité des
familles étudiées, chaque gène ne pouvant expliquer qu’une très faible proportion de
familles. Aucun nouveau gène BRCAx n’a été retenu. De nouvelles analyses de ségré-
gation sont plutôt en faveur d’un modèle récessif ou polygénique, rendant plus dif-
ficile l’identification des gènes responsables.
Autres syndromes héréditaires connus
D’autres syndromes héréditaires, tous de transmission autosomique dominante,
comportent un excès de risque de cancer du sein mais sont exceptionnels : syndrome
de Li-Fraumeni et mutation du gène TP53, maladie de Cowden et mutation du gène
PTEN, syndrome de Peutz-Jeghers et mutation du gène STK11.
184 30es journées de la SFSPM, La Baule, novembre 2008
C. Noguès

Les indications pour une consultation d’oncogénétique
Dans l’immense majorité des cas, l’indication d’une consultation d’oncogénétique
repose sur l’identification des formes familiales de cancer du sein et des ovaires.
Il n’y a pas de caractéristique individuelle ou tumorale spécifique des cancers du
sein survenant dans un cadre de prédisposition. En pratique, on retient seulement
des éléments d’orientation à une prédisposition : l’âge jeune au diagnostic, l’atteinte
bilatérale, l’association à un cancer de l’ovaire (ou à une carcinose péritonéale pri-
mitive), la présence d’un cancer très rare comme un cancer de la trompe ou un cancer
du sein chez un homme. Le type médullaire de cancer du sein est rencontré dix fois
plus souvent dans un contexte BRCA1 que dans un contexte sporadique. Des tumeurs
de grade SBR III, négatives pour les récepteurs hormonaux, sans amplification de
HER2, voire avec un profil basal, sont également fréquentes dans ce cadre.
La reconstitution de l’histoire familiale est donc primordiale, impliquant la
connaissance précise des diagnostics des tumeurs des apparentés, tant dans la branche
paternelle que maternelle. Des critères de sélection de recherche de MC ont été pro-
posés en France par l’expertise collective INSERM-FNLCC en 1998 [1], revus en 2004
[2]. Ils sont toujours d’actualité en 2008. Une analyse moléculaire BRCA1/2 est pro-
posée si la probabilité de prédisposition héréditaire est de 25 %, ce qui correspond à
un taux de détection d’une mutation de 10 à 15 %, d’où les exemples de situations
familiales évocatrices décrits dans le tableau I.
L’établissement d’un score familial peut permettre de poser l’indication d’une
consultation sur des critères volontairement simples pour être facilement utilisables
en pratique (tableau II). Il peut également servir de base à l’indication d’une
recherche de mutation.
TABLEAU I. Exemples de situations familiales avec probabilité de détection d’une mutation d’au moins
10 %.
Au moins trois cas de cancer du sein ou de l’ovaire appartenant à la même branche parentale et
survenant chez des personnes apparentées au premier ou au second degré, si transmission par
un homme.
Deux cas de cancer du sein chez des apparentées du premier degré dont l’âge au diagnostic d’au
moins un cas est inférieur ou égal à 40 ans.
Deux cas de cancer du sein chez des apparentés du premier degré dont au moins un cas est
masculin.
Deux cas chez des apparentées du premier degré dont au moins un cas est un cancer de l’ovaire.
Association d’un cancer du sein et d’un cancer primitif de l’ovaire.
Cancer du sein chez un homme.
Cancer du sein diagnostiqué à moins de 35 ans.
30es journées de la SFSPM, La Baule, novembre 2008 185
La consultation d’oncologie génétique : qui, pourquoi, comment ?

TABLEAU II. Indications de consultation de génétique.
Mutation de BRCA1/2 identifiée dans la famille 5
Cancer du sein chez une femme avant 30 ans 4
Cancer du sein chez une femme entre 30 et 39 ans 3
Cancer du sein chez une femme entre 40 et 49 ans 2
Cancer du sein chez une femme entre 50 et 70 ans 1
Cancer du sein chez un homme 4
Cancer de l’ovaire 3
Additionner chaque cas de la même branche parentale : 5 = excellente indication ; 4 ou 3 = indication possible ; 2
ou 1 = utilité médicale faible.
Pour le calculer, il faut additionner les poids respectifs de chaque situation envi-
sagée dans le tableau, en séparant bien chaque branche familiale (par exemple, on
ne comptabilise pas dans le même score un cas de cancer du sein chez une tante
paternelle et chez une tante maternelle) et en ne retenant que des personnes ayant
des gènes en commun. Si une personne est atteinte de plusieurs cancers différents
(sein + ovaire), les poids de chaque situation s’ajoutent, en tenant compte de l’âge
de survenue. S’il existe des cas de cancers du sein et des ovaires dans les deux branches
familiales, le score le plus élevé sera retenu. Selon le score familial obtenu, l’indication
d’une consultation d’oncogénétique est considérée comme excellente, possible, ou
d’utilité médicale faible.
Il faut néanmoins souligner que les indications retenues par le calcul de ce score
ne correspondront pas toutes à une prédisposition héréditaire et, à l’inverse, que de
bonnes indications peuvent ne pas être repérées par ce mode de calcul. Ce score n’a
pas fait l’objet d’études de sensibilité.
Déroulement de la consultation d’oncogénétique
Déroulement de base d’un test génétique :
• Consultation(s) – temps 1 – : motif de la démarche et attentes, reconstitution de l’histoire familiale,
+/– indication test, information individuelle/familiale, support écrit.
• Période de réflexion, accompagnement psychologique proposé.
• Consultation – temps 2 – : information bis, consentement.
• Analyse laboratoire : 7 mois cas index, 1 mois test ciblé.
• Consultation(s) – temps 3 – : résultat, organisation du suivi éventuel, RCP, accompagnement psy-
chologique, diffusion familiale de l’information.
186 30es journées de la SFSPM, La Baule, novembre 2008
C. Noguès

L’évaluation du risque familial
Toutes les personnes concernées en raison de leur histoire familiale de cancer
peuvent prendre rendez-vous elles-mêmes ou, mieux, par l’intermédiaire de leur
médecin traitant. Le délai d’attente varie d’un centre d’oncogénétique à l’autre et peut
être long pour un premier contact avec la famille (plusieurs mois), mais il y a rarement
de caractère d’urgence. Il s’agit d’une démarche qui nécessite un délai de réflexion.
La demande de la personne doit être considérée en premier lieu, aussi bien dans
une indication un peu limite et si la demande est nettement formulée que, a contrario,
si la consultante est réticente vis-à-vis de cette démarche, même si le risque familial
est très élevé.
Qui vient à la consultation d’oncogénétique ?
Il n’est pas nécessaire, dans un premier temps, que plusieurs membres de la famille
se rendent à la consultation. La personne qui vient devra en revanche avoir collecté
le maximum d’informations pour permettre d’évaluer son risque familial de cancer.
Si des tests génétiques sont indiqués, il sera souhaitable de voir en consultation
une personne de la famille atteinte d’un cancer du sein ou de l’ovaire. Ces consul-
tations peuvent avoir lieu dans des villes différentes pour les membres d’une même
famille : le réseau national le permet.
Que fait-on lors d’une consultation d’oncogénétique ?
La première entrevue est une consultation d’information collectant les données
de l’histoire familiale. Un arbre généalogique est dessiné. Ces éléments permettent
d’évaluer le risque de cancer et d’adapter la surveillance (ou la prise en charge médi-
cale). La réalisation des tests génétiques sera indiquée uniquement chez les personnes
présentant un risque élevé. En général, aucune analyse ou prélèvement n’est réalisé
au cours de la première consultation, le consentement éclairé écrit de la patiente
étant requis. Une période de réflexion est recommandée avant de les réaliser et la
personne pourra rencontrer un psychologue dans ce laps de temps.
La réalisation du test génétique
Les analyses moléculaires sont actuellement proposées lorsque l’histoire d’une
famille est compatible avec la transmission autosomique dominante d’un gène de
prédisposition.
Chez qui est réalisé le test génétique ?
Il concernera une personne atteinte si possible parmi celles atteintes à l’âge le plus
jeune, dans la mesure où elles ont la probabilité la plus élevée d’être porteuse d’une
anomalie génétique constitutionnelle. Dans les familles où aucune personne atteinte
n’est accessible, il peut être envisagé chez d’autres membres de la famille, après éva-
luation oncogénétique.
30es journées de la SFSPM, La Baule, novembre 2008 187
La consultation d’oncologie génétique : qui, pourquoi, comment ?
 6
6
 7
7
 8
8
 9
9
1
/
9
100%