Mécanismes réactionnels en chimie organique

Mécanismes réactionnels en chimie organique
I) Déplacements des électrons
1) Electronégativité et polarisation d'une liaison
L'électronégativité est une grandeur sans
dimension traduisant la tendance d'un atome à attirer
à lui les électrons des liaisons dans lesquelles il est
engagé.
L'échelle d'électronégativité la plus courante est
l'échelle de Pauling (ci-contre) où on constate que
l'électronégativité augmente le long d'une ligne
(période) et diminue le long d'une colonne.
L'élément le plus électronégatif est donc le fluor (les
gaz nobles n'ont pas de réactivité chimique).
En ce qui concerne la chimie organique, l'oxygène
est électronégatif, l'azote aussi alors que le carbone
et l'hydrogène ne le sont pas.
La liaison A-B est polarisée ainsi car A est plus électronégatif que B.
Exemples
Une liaison covalente est la mise en commun
de deux électrons de deux atomes. Ils forment alors
un doublet liant (les deux atomes). Cependant,
l'atome le plus électronégatif a tendance à "attirer" à
lui les électrons de la liaison. Il s'ensuit une
polarisation de la liaison. Plus la différence
d'électronégativité est importante, plus la liaison est
polarisée.
Une liaison sera dite apolaire si la différence
d'électronégativité entre les deux atomes est faible
( > 0,3). A l'inverse, une liaison totalement
polarisée est une liaison ionique ( > 2,0).
Remarque: | +| = | -| < e = 1,6.10-19 C sinon les deux atomes sont dissociés, ce qui est le cas dans la liaison
ionique.
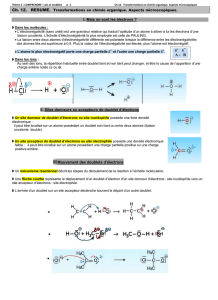
2) Sites donneurs ou accepteurs de doublet d'électrons
La représentation de Lewis fait apparaître les
doublets liants mais aussi les doublets non liants des atomes. En
ce qui concerne la majorité des atomes de la chimie organique,
nous considérerons qu'ils respectent la règle de l'octet.
Compléter le tableau ci-contre:
Atome
H
C
N
O
Cl
Nombre de
doublets liants
Nombre de
doublets non liants
Un atome qui perd un doublet liant et donc gagne un
doublet non liant porte une charge négative - e.
Un atome qui perd un doublet non liant car celui-ci se
transforme en doublet liant porte une charge positive + e.
C'est ceci qui permettra d'expliquer les formations de liaisons
intermédiaires dans les mécanismes réactionnels.
Un site donneur de doublet d'électrons est donc un site de forte densité électronique généralement
localisé sur un atome possédant un doublet non liant ou entre deux atomes liés par une liaison
multiple.
A l'inverse, un site sera accepteur de doublets d'électrons si sa densité électronique est faible. C'est le
cas des atomes porteurs de la "charge" + d'une liaison polarisée.

3) Mécanisme réactionnel
Le mécanisme réactionnel décrit les différentes étapes d'une réaction chimique à l'échelle moléculaire. En
effet, une réaction se fait en général en plusieurs étapes rapides ou non. Des intermédiaires vont apparaître
lors de la formation de liaisons temporaires. On utilise le modèle de la flèche courbe traduisant le
mouvement des doublets électroniques pour rendre compte des interactions entre réactifs.
Cette flèche courbe part d'un doublet d'électrons d'un site donneur et pointe vers un site accepteur de
doublets d'électrons.
Lors d'une même étape, les déplacements d'électrons sont simultanés.
II) Acétanilide
1) Bilan macroscopique de la synthèse
Entourer et nommer les groupes caractéristiques de l'aniline et de l'acétanilide.
Lors de cette transformation chimique, le groupe du réactif principal (aniline) est modifié.
Il est remplacé par un groupe .
Il s'agit d'une réaction de .
2) Mécanisme réactionnel
- Quel est le site donneur de doublet?
- Quel site est susceptible de recevoir ce doublet?
- La première étape du mécanisme réactionnel est une addition. Le doublet de l'atome d'azote se lie
au carbone du groupe carbonyle. Dans le même temps, un doublet de la double liaison C=O se replie
sur l'atome d'oxygène.
Sur le schéma ci-dessous, indiquer les polarisations des liaisons N – H et C=O.
Représenter par des flèches courbes les mouvements des doublets électroniques ainsi que le produit
de cette première étape:
- Deuxième étape: l'atome d'oxygène porteur de la charge reforme une double liaison avec l'atome de
carbone pendant qu'un ion carboxylate se forme. C'est la phase de dissociation.
Représenter par des flèches courbes les mouvements des doublets électroniques ainsi que les produits
de cette deuxième étape:

- Troisième étape: l'atome d'azote récupère son doublet tandis que l'ion carboxylate ouvre son doublet
pour fixer le proton. Il s'agit d'une réaction acide-base.
Représenter par des flèches courbes les mouvements des doublets électroniques ainsi que le produit
de cette troisième étape:
III) Acide acétylsalicylique
1) Bilan macroscopique de la synthèse
Entourer et nommer les groupes caractéristiques de l'acide acétylsalicylique et de l'acide salicylique.
Lors de cette transformation chimique, le groupe du réactif principal (acide salicylique) est
modifié. Il est remplacé par un groupe .
Il s'agit d'une réaction de .
2) Mécanisme réactionnel
- Quel est le site donneur de doublet?
- Quel site est susceptible de recevoir ce doublet?
- La première étape du mécanisme réactionnel est une addition. Le doublet de l'atome d'oxygène se
lie au carbone du groupe carbonyle. Dans le même temps, un doublet de la double liaison C=O de
l'anhydride éthanoïque se replie sur l'atome d'oxygène.
Sur le schéma ci-dessous, indiquer les polarisations des liaisons O – H et C=O.
Représenter par des flèches courbes les mouvements des doublets électroniques ainsi que le produit
de cette première étape:
- Deuxième étape: l'atome d'oxygène porteur de la charge reforme une double liaison avec l'atome de
carbone pendant qu'un ion éthanoate te se forme. C'est la phase de dissociation.

Représenter par des flèches courbes les mouvements des doublets électroniques ainsi que les produits
de cette deuxième étape:
- Troisième étape: l'atome d'oxygène récupère son doublet tandis que l'ion carboxylate ouvre son
doublet pour fixer le proton. Il s'agit d'une réaction acide-base.
Représenter par des flèches courbes les mouvements des doublets électroniques ainsi que le produit
de cette troisième étape:
IV) Paracétamol
1) Bilan macroscopique de la synthèse
Entourer et nommer les groupes caractéristiques du para-aminophénol et du paracétamol.
Lors de cette transformation chimique, le groupe du réactif principal (para-aminophénol)
est modifié. Il est remplacé par un groupe .
Il s'agit d'une réaction de .
2) Mécanisme réactionnel
En se basant sur ce qui précède, décrire les trois étapes du mécanisme réactionnel de cette synthèse.
20; 21; 22 p 283
1
/
4
100%