La FDA approuve les capsules Erivedge (vismodegib

Communiqué de presse
F. Hoffmann-La Roche Ltd 4070 Basel
Switzerland
Group Communications
Roche Group Media Relations
Tel. +41 61 688 88 88
Fax +41 61 688 27 75
www.roche.com
1/4
Bâle, le 30 janvier 2012
La FDA approuve les capsules Erivedge (vismodegib), premier médicament pour
les adultes souffrant de carcinome basocellulaire avancé
Erivedge, premier inhibiteur de la voie de signalisation hedgehog, favorise la régression de lésions
défigurantes ou de nature à compromettre le pronostic vital lors de cancer de la peau de stade avancé
Roche (SIX: RO, ROG; OTCQX: RHHBY) a annoncé aujourd’hui que les capsules Erivedge (vismodegib) ont
été homologuées par la U.S. Food and Drug Administration (FDA) pour le traitement d’adultes avec
carcinome basocellulaire (CBC), forme de cancer de la peau, s’étant propagé à d’autres parties de l’organisme
ou étant réapparu après chirurgie ou étant considéré par un professionnel de santé comme ne se prêtant pas à
la chirurgie ou la radiothérapie. Erivedge est le premier médicament approuvé par la FDA pour le traitement
des personnes présentant cette forme de cancer de la peau, la plus courante, aux stades avancés. Le
médicament se présente sous la forme d’une capsule prise une fois par jour par voie orale.
Le carcinome basocellulaire est généralement considéré comme curable lorsque le cancer est limité à une
petite surface de peau. Toutefois, dans de rares cas, les lésions peuvent devenir défigurantes et envahir les
tissus avoisinants (forme localement avancée), ou encore donner lieu à des métastases dans d’autres parties
de l’organisme. Dans ces cas de CBC évolué, la maladie ne peut être traitée efficacement par chirurgie ou
radiothérapie. Le CBC de stade avancé se traduit souvent par une difformité sévère ou une perte de fonction
des organes affectés.
Hal Barron, M.D., Chief Medical Officer et responsable de Global Product Development: “L’homologation
accordée aujourd’hui offre un nouveau traitement aux personnes souffrant de carcinome basocellulaire
avancé, pour lesquelles il n’existait jusqu’à présent aucun médicament agréé favorisant la régression de
lésions défigurantes ou pouvant engager le pronostic vital. Nous sommes heureux d’avoir pu, au cours des six
derniers mois, proposer deux nouveaux médicaments pour différents types de cancers cutanés de stade
avancé à des personnes précédemment en manque de solutions thérapeutiques.”
Erivedge sera disponible aux Etats-Unis une à deux semaines après son homologation et sera distribué via des
pharmacies spécialisées. Roche a également déposé une demande d’autorisation de mise sur le marché

2
/
4
(AMM) pour Erivedge dans l’Union européenne (UE). Afin que les personnes souffrant de CBC avancé et
vivant hors des Etats-Unis aient accès à Erivedge pendant que Roche s’emploie à obtenir les AMM à l’échelle
mondiale, l’entreprise mène dans l’UE et d’autres pays une étude d’innocuité de phase II qui recrute des
patients avec CBC évolué. Pour de plus amples informations, veuillez consulter le site suivant:
http://www.rochetrials.com
Efficacité d’Erivedge lors de carcinome basocellulaire avancé
L’homologation d’Erivedge par la FDA se fonde sur les résultats d’ERIVANCE BCC (SHH4476g), étude pivot
internationale de phase II multicentrique à un bras, menée en mode ouvert et comportant deux cohortes, qui
a recruté 104 patients avec CBC avancé, dont 71 avec CBC localement évolué et 33 avec CBC métastatique.
L’étude a montré qu’Erivedge avait réduit la taille des tumeurs (ORR, taux de réponse objective) chez 43 pour
cent (27/63) des patients avec CBC localement avancé et 30 pour cent (10/33) des patients avec CBC
métastatique, sur la base de l’analyse menée par un comité d’évaluation indépendant (critère d’évaluation
primaire de l’étude). La durée médiane de la réponse a été de 7,6 mois.
Les patients avec CBC localement avancé présentaient des lésions réapparues après chirurgie, non accessibles
à la chirurgie (inopérables ou en présence desquelles la chirurgie aurait entraîné une difformité substantielle),
réapparues après radiothérapie ou non accessibles à une radiothérapie (celle-ci étant contre-indiquée ou
considérée comme inappropriée). Les participants à l’étude ont reçu 150 mg d’Erivedge par voie orale une
fois par jour jusqu’à la progression de la maladie ou l’apparition d’une toxicité inacceptable.
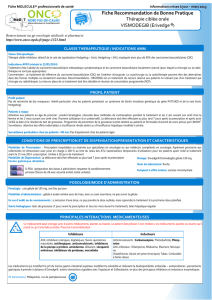
Innocuité d’Erivedge
Les effets indésirables d’Erivedge les plus courants sont les suivants: crampes musculaires, chute des cheveux,
modifications ou perte du goût, perte de poids, fatigue, nausées, diarrhée, perte d’appétit, constipation,
vomissements et douleurs articulaires. Autres effets indésirables potentiels d’Erivedge: absence de règles chez
des femmes aptes à la procréation, faibles taux de sodium dans le sang, faibles taux de potassium et taux
sanguins anormalement élevés d’urée ou d’autres composants azotés. Les patients sont invités à informer leur
médecin de tout effet indésirable gênant ou persistant.
Prière de consulter l’information détaillée sur Erivedge, y compris l’encadré AVERTISSEMENT et le guide
du médicament sur le site http://www.Erivedge.com.

3
/
4
A propos du carcinome basocellulaire et de la voie hedgehog
Le carcinome basocellulaire (CBC) est le type de cancer de la peau le plus fréquent en Europe1, en Australie1,2
et aux Etats-Unis3. Lors de CBC avancé, si la maladie n’est pas traitée ou réapparaît au même endroit après
chirurgie ou radiothérapie, elle peut envahir des zones environnantes tels que les organes sensoriels (oreilles,
nez et yeux), les os et d’autres tissus. Selon la localisation de la lésion, le CBC avancé peut, dans certains cas,
s’avérer défigurant; la chirurgie ou la radiothérapie peuvent alors entraîner une perte des organes sensoriels
et de leurs fonctions telles que la vision ou l’audition.
La voie de signalisation hedgehog joue un rôle important dans la régulation des processus normaux de
croissance et de développement au cours des premiers stades de la vie et devient moins active chez l’adulte.
Des anomalies de cette voie de signalisation sont impliquées dans plus de 90 pour cent des cas de CBC.
A propos d’Erivedge (vismodegib)
Erivedge est un médicament oral conçu pour inhiber sélectivement un défaut de signalisation dans la voie
hedgehog, qui est un promoteur moléculaire sous-jacent du CBC. Roche et Genentech évaluent également
Erivedge dans le cadre d’une étude de phase II menée chez des patients présentant des formes opérables de
CBC.
Roche développe Erivedge dans le cadre d’un accord de coopération avec Curis, Inc. Erivedge a été découvert
par Genentech et validé conjointement par Genentech et Curis par le biais d’une série d’études précliniques.
Dans le cadre de cette collaboration, Genentech (Etats-Unis), Roche (en dehors des Etats-Unis, mais à
l’exclusion du Japon et de la Corée) et Chugai Pharmaceuticals (Japon) sont conjointement responsables du
développement clinique et de la commercialisation d’Erivedge. Curis pourra bénéficier de paiements en cash
lorsque le développement clinique défini aura été mené à bien et que les étapes du processus d’homologation
auront été passées avec succès, et pourra percevoir des royalties sur les ventes d’Erivedge.
Pour de plus amples informations sur Erivedge, consulter le site http://www.Erivedge.com
A propos de Roche
Roche, dont le siège est à Bâle, Suisse, figure parmi les leaders de l’industrie pharmaceutique et
diagnostique axée sur la recherche. Numéro un mondial de la biotechnologie, Roche produit des
médicaments cliniquement différenciés pour le traitement du cancer, des maladies virales et

4
/
4
inflammatoires ainsi que des maladies du métabolisme et du système nerveux central. Roche est aussi
le leader mondial du diagnostic in vitro ainsi que du diagnostic histologique du cancer, et une
entreprise pionnière dans la gestion du diabète. Sa stratégie des soins personnalisés vise à mettre à
disposition des médicaments et des outils diagnostiques permettant d’améliorer de façon tangible la
santé ainsi que la qualité et la durée de vie des patients. En 2010, Roche, qui comptait plus de 80 000
employés dans le monde, a consacré à la R&D plus de 9 milliards de francs. Son chiffre d’affaires s’est
élevé à 47,5 milliards de francs. Genentech, Etats-Unis, appartient entièrement au groupe Roche, qui
détient en outre une participation majoritaire au capital de Chugai Pharmaceutical, Japon. Pour de
plus amples informations, consulter le site internet du groupe à l’adresse www.roche.com.
Tous les noms de marque mentionnés sont protégés par la loi.
Relations avec les médias au niveau du groupe Roche
Téléphone: +41 -61 688 8888 / e-mail: [email protected]
- Alexander Klauser (responsable du bureau des médias)
- Silvia Dobry
- Daniel Grotzky
- Claudia Schmitt
Références
1. N.R.Telfer, G.B.Colver and C.A.Morton. Guidelines for the management of basal cell carcinoma. The British Journal of
Dermatology. 2008;158(7):35-48
2. Gilbody JS, et al. What causes basal cell carcinoma to be the commonest cancer? Aust J Public Health.1994; 18(2):218-21
3. Von Hoff et al. Inhibition of the hedgehog pathway in advanced basal-cell carcinoma. New Engl J Med. 2009;361:1164-1172
1
/
4
100%