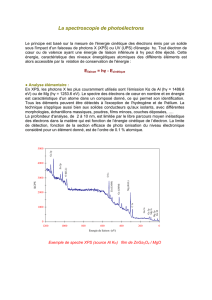
Chimie II

Chimie II Propriétés périodiques
Module 1 Travail 7
Solutionnaire
Travail- Les propriétés périodiques
1. Schéma – Variation des rayons atomiques (p.128)
Rayon atomique

2. Schéma- Ce qui arrive à la grandeur d’un atome lorsqu’il perd et lorsqu’il gagne
un é. (p.130)
gagne é : le nuage électronique augmente (Cl-)
perd é : le nuage électronique diminu (Na+)
3. Pourquoi les atomes métalliques forment-ils des ions plus petits qu’eux?
C’est parce qu’ils forment des cations, c’est-à-dire qu’ils donnent un ou plusieurs
électrons. Le nuage électronique diminu. (Lorsque le cation cède ses é périphériques, la
charge + de son noyau devient supérieur à la charge – de son nuage électronique—ce
nuage se rétrécit.)
4. Pourquoi les atomes non métalliques forment-ils des ions plus gros qu’eux?
C’est parce qu’ils forment des anions, c’est-à-dire qu’ils gagnent un ou plusieurs
électrons. Le nuage électronique augmente.
5. Exercices 1 à 3 p.131-132
1. a) Ar b) B c) O2- d) Mg e) P f) Cl
g) Ca h) S2- i) Ti
2. Voir tableau 7.1 p.129 Tendance du rayon atomique Formation des ions
3. Possède 2 électrons sur son dernier niveau d’énergie. Pour être stable, c’est-à-dire
possèder 8 é périphérique, il doit donner ces 2 é.

6. Comment fait-on pour prédire le degré d’oxydation d’un élément? (p.133)
On peut prédire le degré d’oxydation des éléments selon leur position dans le
tableau périodique. (famille alcalins 1+ famille des alcalino-terreux 2+
famille des halogènes 1- famille des gaz rares 0 etc.)
7. Schéma- Tendance des nombres d’oxydation des éléments (p.133)
8. Définitions
Énergie d’ionisation : L’énergie nécessaire pour arracher un électron à un atome.
Électronégativité : La force avec laquelle les protons à l’intérieur du noyau
attirent les électrons de valence chez un élément
Affinité électronique : Attraction d’un atome pour un électron supplémentaire
9. Schéma – Tendance de l’énergie de première ionisation (p.136)
Énergie d’ionisation

10. En général, l’énergie d’ionisation des métaux est faible tandis que celle des
non-métaux est forte.
11. Que veut dire l’effet d’écran ou l’effet bouclier? (p.137)
C’est la diminution de l’attraction entre le noyau et les électrons périphériques due
à la présence d’autres électrons qui s’interposent entre eux. Cet effet est plus marqué
sur les éléments qui possèdent un plus grand rayon atomique.
12. Quatre facteurs qui jouent un rôle sur l’énergie d’ionisation. (p.137)
charge nucléaire - plus la charge nucléaire est considérable, plus l’énergie
d’ionisation est élevée.
effet d’écran - plus l’effet d’écran est fort, moins l’énergie d’ionisation est
élevée.
rayon - plus la distance est le noyau et les électrons périphériques d’un
atome est grande, moins l’énergie d’ionisation est élevée.
sous-niveau - un électron occupe un sous-niveau rempli ou à demi rempli requiert
un surplus d’énergie pour être arraché à son atome.
13. Les définitions (L’énergie d’ionisation augmente pour chaque é additionnel qu’on arrache)
Énergie de deuxième ionisation Énergie nécessaire pour arracher le 2e é d’un atome
Énergie de troisième ionisation Énergie nécessaire pour arracher le 3e é d’un atome

14. Exercices 16, 20, 30, 32, 33, 44 et 46 p.140-141
16. a) Ag b) Br1- c) K d) Na e) Cl1- f) Co g) P3- h) Sn
20.a) 8 é périphérique b) max d’é périphérique c) néon
30. Non-métaux énergie de première ionisation est + grande que celle des métaux
32. Nd (néodyme Z=60) 33. Se (sélénium)
44. a) As3- + é donc + de répulsion…. + gros nuage électronique
b) Tl1+ perd – é donc + de répulsion… + gros nuage électronique
46. Parce que l’argent possède des 10 é dans l’orbital 4d . Effet d’écran est + grand.
15. Exercices 2 et 10 (sauf h et i) p. 142
2. mam = 24,309 551 u
10. a) élément situé dans les d sauf ceux se terminant par s1d10 ou s2d10
b) les gaz rares, éléments de transition, les séries
c) alcalins
d) famille de l’azote
e) élément situé dans l’orbital f sauf ceux se terminant en f14
f)
g) les halogènes
j) élément de la période 4
k) les alcalins, les alcalino-terreux, la famille du bore, les métaux de transition et
les séries.
l) la famille de l’azote, la famille de l’oxygène et les halogènes
m) les alcalins, les alcalino-terreux, la famille du bore, les métaux de transition et
les séries.
n) les séries
o) les métalloïdes (B, Si, Ge, As, Sb, Te, Po)
p) la famille de l’azote, la famille de l’oxygène et les halogènes
q) les halogènes
r) les métaux
s) éléments Z= 90 (thorium) à Z= 102 (nobélium)
1
/
5
100%