Voir/Ouvrir

1
TABLE DES MATIERES.
Page
INTRODUCTION ................................................................................................ 1
MATERIELS ET METHODE ............................................................................ 2
PARTIE A ALIMENTATION DE L’ENFANT ET DEL’ADOLESCENT
CHAPITRE I : ALIMENTATION DU NOURRISSON ET DE L’ENFANT EN
BAS AGE
I. PERIODE DE L'ALIMENTATION LACTEE EXCLUSIVE .............................. 4
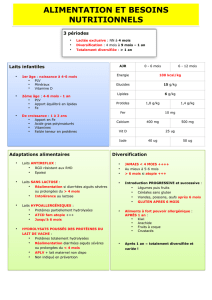
1. Le lait maternel. ............................................................................................ 4
1-1 Composition et variabilité du lait de femme. ........................................... 5
1-2 L’allaitement maternel et prévention des maladies. .............................. 8
1-3 Suppléments en sels minéraux, oligoéléments et vitamines. ................... 9
2. lait de vache ................................................................................................... 9
3. Les substituts du lait maternel .................................................................... 10
3-1 Préparations pour nourrissons ................................................................ 10
3-2 Préparations de suite. .............................................................................. 11
3-3 Aliments spéciaux et substituts du lait .................................................... 11
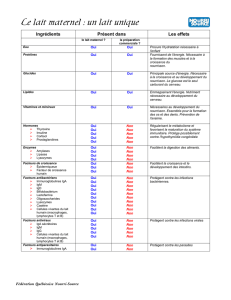
I. DIVERSIFICATION ALIMENTAIRE .................................................................. 14
1. Modalités de la diversification alimentaire ............................................... 14
2. La poursuite de la diversification ............................................................... 16
3. Les erreurs nutritionnelles les plus courantes de l’enfance ..................... 18
III - PREVENTION DES ALLERGIES ALIMENTAIRES .................................... 19

2
CHAPITRE II : ALIMENTATION DE L’ENFANT A PARTIR DE 3 ANS ET
JUSQU’A L’ADOLESCENCE.
I - LES RYTHMES ALIMENTAIRES ...................................................................... 22
1. Conséquences des modalités des prises alimentaires ................................ 22
2. Conséquences des prises alimentaires multiples ...................................... 23
II - LA CONSOMMATION ALIMENTAIRE CHEZ L’ENFANT DE PLUS DE
3 ANS ET DE L’ADOLESCENT ................................................................................ 23
1. Augmenter la consommation de fruits et légumes .................................... 24
2. Augmenter la consommation de calcium et de la vitamine D .................. 24
3. Les risques d’une consommation excessive de lipide................................ 25
4. Consommation des glucides ........................................................................ 26
5. L’activité physique ..................................................................................... 27
6. Les régimes restrictifs .................................................................................. 29
7. Végétarisme et végétalisme ......................................................................... 30
PARTIE B REGIMES DIVERS EN PATHOLOGIES PEDIATRIQUES
CHAPITRE I : DIETETIQUE ET TROUBLES DIGESTIFS.
I - LE REFLUX GASTRO-ŒSOPHAGIEN.............................................................. 32
1. Définition ...................................................................................................... 32
2. Les erreurs diététiques à l’origine des régurgitations ............................ 32
3. Traitements .................................................................................................. 32
II - VOMISSEMENTS ACETONEMIQUES ............................................................ 34
1. Le traitement ................................................................................................ 34
III - CONSTIPATION FONCTIONELLE DU NOURISSON ET DU
JEUNE ENFANT .......................................................................................................... 34
1. Mesures diététiques ..................................................................................... 35

3
IV- DIARRHEES AIGUËS DU NOURRISSON ET DU JEUNE
ENFANT ................................................................................................................. 37
1. Prise en charge diététique de la diarrhée aiguë ...................................... 37
1-1 Réhydratation orale ................................................................................. 37
1-2-Renutrition précoce. ................................................................................ 38
2. Prévention nutritionnelle de la diarrhée ................................................... 40
V- COLON IRRITABLE ............................................................................................. 41
1. Prise en charge diététique ........................................................................... 41
CHAPITRE II : INTOLERANCES ET ALLERGIES ALIMENTAIRES.
I - ALLERGIE AUX PROTEINES DU LAIT DE VACHE .................................... 42
1. Chez le jeune nourrisson de moins de 6 mois. ........................................... 42
2. Chez le nourrisson âgé de plus de 6 mois .................................................. 42
3. Durée du régime ........................................................................................... 44
4. Prévention ..................................................................................................... 46
II- REGIME DE L’INTOLERANCE AU LACTOSE .............................................. 47
1. Régime en pratique ...................................................................................... 47
2. Allergie alimentaire au lait de vache ou intolérance au lactose ? .......... 48
III- INTOLERANCE AU GLUTEN ........................................................................... 48
1. Régime sans gluten en pratique .................................................................. 49
2. Indications du régime sans gluten chez l’enfant ....................................... 51
CHAPITRE III : MALADIES METABOLIQUES ET HEREDITAIRES.
I- REGIME DES INTOLERANCES AUX SUCRES ................................................ 52
1. Régime de l'intolérance héréditaire au fructose ...................................... 52
1-1 Principes de la prise en charge diététique ............................................... 52
1-2 Problèmes posés par le régime. ............................................................... 53
2. Régime de la galactosémie ........................................................................... 55

4
2-1 Principes du régime. ................................................................................ 55
2-2 Régime en pratique. ................................................................................. 56
2-3 Durée du régime. ..................................................................................... 56
2-4 Principes de surveillance et devenir à long terme ................................... 58
3. Régime du déficit en saccharase-isomaltase ............................................. 58
3-1 Principes du régime ................................................................................. 58
3-2 Régime en pratique. ................................................................................. 58
3-3 Durée du régime. ..................................................................................... 59
4. Régime des malabsorptions du glucose et du galactose par anomalie
du transporteur intracellulaire ........................................................................ 61
II- LA PHENYLCETONURIE. .................................................................................. 61
1. Principe et réalisation pratique du régime ................................................ 61
1-1 Aliments utilisés dans le régime. ............................................................. 61
1- 2 Choix du régime. .................................................................................... 66
1 - 3 Indications du régime pauvre en PHE. .................................................. 70
III- LA MUCOVISCIDOSE. ...................................................................................... 70
1. Définition ...................................................................................................... 70
2. Déficit nutritionnel ....................................................................................... 71
3. Prise en charge nutritionnelle ..................................................................... 71
3-1 En absence de situation de dénutrition ou à risque de dénutrition. ......... 71
3-2 En cas de situation de dénutrition ou à risque de dénutrition. ................. 73
IV- LES HYPERCHOLESTEROLEMIES DE L’ENFANT ................................... 75
1. Introduction .................................................................................................. 75
2. Le traitement diététique .............................................................................. 75
2-1 Limiter les graisses .................................................................................. 76
2-2 Rééquilibrer les acides gras. .................................................................... 76
2-3.Augmenter les apports en fruits et légumes. ........................................... 77
2-4 Préparation des aliments .......................................................................... 77

5
V - DIABETE DE L’ENFANT ET DE L’ADOLESCENT ...................................... 78
1. Introduction .................................................................................................. 78
2. Prise en charge diététique ........................................................................... 79
VI- L’OBÉSITÉ CHEZ LE JEUNE ENFANT ....................................................... 83
1. Le risque de voir se développer une obésité ? .......................................... 84
2. Facteurs favorisant la prise de poids excessive ......................................... 84
3. Recommandations pratiques ...................................................................... 85
CHAPITRE IV : DIETETIQUE ET NEPHROPATHIES DE L’ENFANT.
I- INTRODUCTION .................................................................................................... 88
II- REGIMES RESTREINTS EN SODIUM ............................................................ 88
1. Indications .................................................................................................... 88
2. Apport de sodium restreint ......................................................................... 89
3. Restriction de sodium sévère ...................................................................... 90
III- DIETETIQUE DE L’INSUFFISANCE RENALE CHRONIQUE
ET TERMINALE.................................................................................................... 91
IV- DIETETIQUE DE L’INSUFFISANCE RENALE AIGUE .............................. 98
V- DIETETIQUE DES ENFANTS TRANSPLANTES ............................................ 99
VI- DIETETIQUE DU SYNDROME NEPHROTIQUE ......................................... 100
VII- DIETETIQUE DES DEFAUTS DE CONCENTRATION URINAIRE,
EXEMPLE DU DIABETE INSIPIDE NEPHROGENIQUE .......................... 101
VIII- DIETETIQUE DES LITHIASES ..................................................................... 101
1. Lithiases oxaliques .................................................................................. 101
2. Lithiases uriques ..................................................................................... 102
CHAPITRE V : LES MALADIES CARDIOVASCULAIRES.
I- DIETETIQUE DE L’ENFANT CARDIAQUE .................................................... 103
II-L’HYPERTENSION ARTERIELLE CHEZ L’ENFANT .................................. 104
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
 58
58
 59
59
 60
60
 61
61
 62
62
 63
63
 64
64
 65
65
 66
66
 67
67
 68
68
 69
69
 70
70
 71
71
 72
72
 73
73
 74
74
 75
75
 76
76
 77
77
 78
78
 79
79
 80
80
 81
81
 82
82
 83
83
 84
84
 85
85
 86
86
 87
87
 88
88
 89
89
 90
90
 91
91
 92
92
 93
93
 94
94
 95
95
 96
96
 97
97
 98
98
 99
99
 100
100
 101
101
 102
102
 103
103
 104
104
 105
105
 106
106
 107
107
 108
108
 109
109
 110
110
 111
111
 112
112
 113
113
 114
114
 115
115
 116
116
 117
117
 118
118
 119
119
 120
120
 121
121
 122
122
 123
123
 124
124
1
/
124
100%