La respiration

Groupe B1/8
Bourgeois Yann
Brozicevic Stéphane
Engerer Aurélien
Physiologie respiratoire
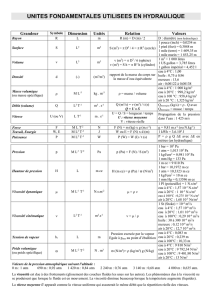
Ce graphique représente les variations des pressions partielles (Pp) de l’oxygène et de l’azote pour
différentes altitudes mais en mettant le poids sur l’immersion à différente profondeur. On observe que
la PpN2 augmente beaucoup plus rapidement que celle de l’O2 lorsque l’altitude diminue. De plus les
variations de Pp sont beaucoup plus importantes sous l’eau du fait de la pression exercée par l’eau,
qu’en altitude.
A 5400 m. d’altitude, la P
pO2 ainsi que la P
pN2 sont divisées par deux environ ( on passe
respectivement de 0.21 atm à 0.10 atm et de 0.83 atm à 0.41 atm). Or nous savons que les échanges
gazeux au niveau alvéolaire dépendent des Pp des gaz, de ce fait les échanges gazeux diminuent de
moitié pour l’O2. Cela entraîne un état d’hypoxie d’origine respiratoire pouvant être compenser par
l’apport d’O2 via des appareils respiratoires ou bien en acclimatant son organisme.
En plongée, on considère que la pression exercée par l’eau augmente d’un 1atm tous les 10 m., donc à
10m. la pression totale est de 1+1 atm. Lorsque l’on dépasse une P
pO2 de 2 atm il y a
empoissonnement par l’O2. En effet une concentration en O2 trop importante induit la formation de
nombreux radicaux libres (nocifs), pouvant entraîner des lésions au niveau de système nerveux, un
coma voir la mort. De même pour l’N2, lorsque la PpN2 atteint 6 atm, le plongeur se trouve dans un
état de narcose par l’azote. Nous savons que la solubilité d’un gaz varie en fonction de sa Pp, donc en
condition hyperbare l’N2 se dissout en plus grande quantité dans le sang. Or N2 à une plus grande
affinité pour les tissus riches en lipides dont le SNC (d’où l’effet de narcose), la moelle épinière et les
graisses. Le plongeur est alors étourdi, désorienté comme ivre, d’où le terme d’ivresse des profondeurs
pour désigner la narcose par l’azote. Pour éviter les effets néfastes de l’O2 et de l’N2, il suffit de
rajouter au gaz respiratoire un troisième gaz inerte comme l’hélium, sa présence fait chuter les Pp des
deux autres gaz, de ce fait on peut descendre plus bas et avec moins d’effets indésirables.
Chez les apnéistes, le cas est différent. En effet, ils descendent sans l’aide d’appareillage respiratoire,
donc l’air qu’ils ont dans les poumons est à une pression de 1 atm lorsqu’ils prennent leur inspiration.
En descendant la pression augmente, et le volume des poumons tend donc à diminuer car le volume
des gaz diminue lui aussi (d’après la loi de Boyle-Mariotte P1V1=P2V2). Si on considère que le volume
pulmonaire est de 6L. (sous 1 atm), en descendant à 40 m. ce volume n’est plus que de 1,2L.. Le
plongeur a donc un volume pulmonaire à peu près égal au volume résiduel, il risque donc un accident
pulmonaire. Les alvéoles peuvent avoir tendance à s’affaisser et ce qui peut entraîner la mort.
Cependant, ces performances sont possibles chez des individus entraînés et séjournant pendant des
temps très courts à ces profondeurs (environ 2 à 3 min.).
Chez les scaphandriers, on utilise un appareil respiratoire permettant d’égaliser en permanence la
pression du gaz respiratoire inspiré et la pression exercée sur la cage thoracique. A -30m. la pression
est de 4 atm, en remontant brusquement à –10m sans expirer les gaz se détendent et restent dans les
voies aériennes. A –10m. le volume occupé par ces mêmes gaz est alors de 6L. soit le seuil maximal
moyen de la capacité pulmonaire. Les alvéoles sont alors proches de la rupture. De plus lors d’un tel
exercice, il existe un deuxième danger, comme nous l’avions dit précédemment la solubilité d’un gaz
augmente avec sa Pp, donc en remontant rapidement la solubilité des gaz diminue et ce surplus de gaz
sera difficilement éliminable par la voie pulmonaire. Cela entraîne des emboles gazeuses c’est à dire
la formation de bulle de gaz pouvant ce loger dans le cerveau ( dans certain cas extrême on dit que le
sang bouillonne).

Test fonctionnel :
T=0 min T=15 min
Volume courant (VC) 0,23 L 0,23 L.
Volume de réserve inspiratoire
(VRI) 1,97 L 2,42 L.
Volume de réserve expiratoire
(VRE) 1,69 L 1,8 L.
Capacité vitale (CV) 3,89 L 4,45 L.
Volume expiratoire maximal par
seconde (VEMS) 1,74 L. 3,04 L.
Indice de Tiffeneau (T) 44,7 % 68,3 %
A noter : T=VEMS/CV*100 et CV= VC + VRI + VRE
La courbe 1 correspond à une inspiration forcée et rapide, suivie d’une expiration forcée et rapide. Elle
permet de déterminer les paramètres suivant : VC, CV, VRI, VRE. La courbe 2 quant à elle,
correspond à une inspiration forcée suivie d’une expiration forcée dont le but et de vider au maximum
les poumons. On détermine alors la VEMS. La courbe 3 montre que le patient à du mal à expirer lors
d’un exercice intense. Il y a donc augmentation de la résistance des conduits aériens. Le patient, à
T=0, a un indice de Tiffeneau de 44,7%. Au bout de 15 min., on observe une amélioration de la
ventilation, l’indice de Tiffeneau remontant à 68,3%. On remarque que le VC ne varie pas, or T varie,
donc on peut émettre l’hypothèse que le patient présente un phénomène obstructif au niveau des
bronches ( pneumopathies obstructives comme une bronchite ou de l’asthme, voir une obstruction des
voies aériennes supérieur mais cette hypothèse est peu probable au vu des valeurs de T). Toute fois la
valeur de T est encore inférieure aux valeurs normales comprises entre 80 et 90%. L’amélioration
observée au bout de 15 min. peut être du à l’utilisation de broncho-dilatateurs (des agonistes â2-
adrénergiques ).
En altitude, il y a moins d’oxygène disponible pour l’organisme, ce dernier est obligé de s’adapter en
augmentant la synthèse de globules rouges (érythropoïèse). Parallèlement, du à cette hypoxie partielle
on a augmentation du taux de 2,3-Diphosoglycérol (2,3-DPG qui est un métabolite de la glycolyse
anaérobie), permettant un relargage plus facile de l’oxygène au niveau des tissus en diminuant
l’affinité de l’oxygène pour l’hémoglobine. Pour ces raisons, de nombreux sportifs effectuent des
stages en altitude. La testostérone, hormone androgène engendre des effets similaires sur l’organisme,
c’est à dire une hausse de l’érythropoïèse et du taux de 2,3-DPG. La testostérone peut lors d’usage
détourné être considérée comme un produit dopant.
Au niveau des poumons, il existe des récepteurs â2-adrénergiques qui lorsqu’ils sont stimulés par un
agoniste entraîne une bronchodilatation. Or si le diamètre des bronches augmente, cela signifie que la
résistance à l’écoulement de l’air diminue d’où une respiration plus facile et une meilleure
oxygénation. Cela permet donc aux sportifs peu scrupuleux de fournir un effort plus long et intense, et
de récupérer plus facilement. Les agonistes â2-adrénergiques tel que le salbutamol peuvent donc être
considérés comme des dopants.
Références : - Anatomie et physiologie humaine, Elaine N. Marieb ,4° Ed.
- Encyclopédie pratique du médicament , Vidal, 12ème édition
1
/
2
100%