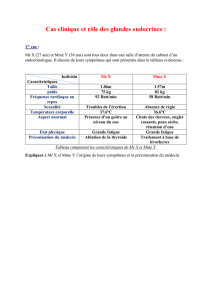
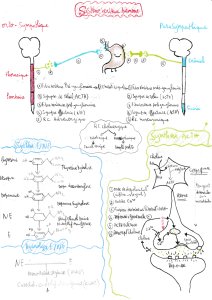
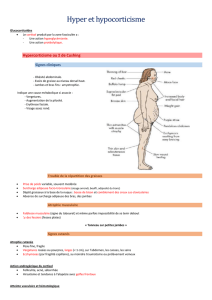
Dosage plasmatique des précurseurs de l`ACTH lors de

ÉCOLE NATIONALE VETERINAIRE D’ALFORT
Année 2004
Dosage plasmatique des précurseurs de l’ACTH lors de
maladie de Cushing chez le chien : intérêt pour la
détection des adénomes hypophysaires de grande taille
THESE
Pour le
DOCTORAT VETERINAIRE
Présentée et soutenue publiquement devant
LA FACULTE DE MEDECINE DE CRETEIL
Le
par
Nicolas, Pierre Granger
Né le 21 juin 1978 à Champigny sur Marne (Val-de-Marne)
JURY
Président :
Professeur à la Faculté de Médecine de CRETEIL
Membres
Directeur : M. Dan Rosenberg
Maître de conférences à l’Ecole Nationale Vétérinaire d’Alfort
Assesseur : Mme Sophie Alcon
Maître de conférences à l’Ecole Nationale Vétérinaire d’Alfort
Invitée : Mme Françoise Delisle, Centre de Cancérologie Vétérinaire

Dosage plasmatique des précurseurs de l’ACTH lors de
maladie de Cushing chez le chien : intérêt pour la
détection des adénomes hypophysaires de grande taille
Nom et Prénom : Granger Nicolas
Résumé :
La détection précoce des tumeurs hypophysaires corticotropes de grande taille chez le
chien repose sur l’emploi d’examens d’imagerie car l’expression clinique de ces tumeurs n’est
pas clairement corrélée à leur taille.
Pour accroître la capacité des vétérinaires à dépister des adénomes corticotropes de
grande taille, nous avons développé un nouvel outil biologique : le dosage des précurseurs de
l’hormone adrénocorticotrope (ACTH) dont la pro-opiomélanocortine (POMC), à l’aide d’une
trousse de dosage : OCTEIA POMC. Ce manuscrit retranscrit les différentes étapes de ce
travail expérimental après une présentation des données bibliographiques concernant
l’adénohypophyse et la maladie de Cushing.
La validation de la trousse OCTEIA POMC chez le chien puis son utilisation chez 36
chiens atteints de maladie de Cushing montre une forte corrélation entre la taille des tumeurs
hypophysaires et la concentration en précurseurs de l’ACTH.
Ces résultats permettent une distinction fonctionnelle des tumeurs hypophysaires selon
leur taille et offrent au clinicien une nouvelle étape simple et rapide dans la démarche
diagnostique étiologique des maladies de Cushing.
Mots clés :
Carnivore ; Chien ; Maladie de Cushing ; Tumeur ; Adénome corticotrope;
Hypophyse ; Diagnostic ; Technique immunoenzymatique ; Pro-opiomelanocortine ;
Hyperadrenocorticisme.
Jury :
Président : Pr.
Directeur : Dr Dan Rosenberg
Assesseur : Dr Sophie Alcon
Invitée : Dr Françoise Delisle
Adresse de l’auteur : Mr Granger Nicolas, 89 rue Condorcet, 94 700 Maisons-Alfort.

Plasma concentrations of adrenocorticotrophic hormone
precursors in dogs with Cushing’s disease : evaluation in
the detetction of large pituitary adenoma
Surname: Granger
Given name: Nicolas
Summary:
It is difficult to predict the size of pituitary corticotroph tumors in dogs with Cushing’s
disease without pituitary imaging techniques because the clinical expression of this tumors is
not clearly correlated with their size.
To increase our capacity in detecting large pituitary corticotroph tumors in dogs, we
develop a new biological test: measurement of plasma adrenocorticotropin hormone (ACTH)
precursors as pro-opiomelanocortin (POMC) with a new kit: OCTEIA POMC. This
manuscript will expose the different steps of this experimental work after a review of the data
concerning the adenohypophysis and pituitary dependent hyperadrenocorticism.
Validation of this kit in dogs and measurement of ACTH precursors in 36 dogs
diagnosed with pituitary corticotroph adenomas of various sizes shows a strong correlation
between tumor size and ACTH precursors concentrations.
Those results lead us to propose a functional distinction between large and small
pituitary tumors and allow to introduce a fast and easy stage for clinician in the etiologic
diagnosis of Cushing’s disease.
Keywords:
Canine; Dog; Cushing’s disease; Tumor; Corticotroph adenoma; Pituitary ;Diagnosis;
Enzyme immunoassay; Pro-opiomelanocortin; Hyperadrenocorticism.
Jury :
President: Pr.
Director: Dr Dan Rosenberg
Assesor: Dr Sophie Alcon
Guest: Dr Françoise Delisle
Author’s address: Mr Granger Nicolas, 89 rue Condorcet, 94 700 Maisons-Alfort.

Juillet 2004
LISTE DES MEMBRES DU CORPS ENSEIGNANT
Directeur : M. le Professeur COTARD Jean-Pierre
Directeurs honoraires : MM. les Professeurs PARODI André-Laurent, PILET Charles
Professeurs honoraires: MM. BORDET Roger, BUSSIERAS Jean, LE BARS Henri, MILHAUD Guy, ROZIER Jacques, THERET Marcel
DEPARTEMENT DES SCIENCES BIOLOGIQUES ET PHARMACEUTIQUES (DSBP)
Chef du département : M. BOULOUIS Henri-Jean, Professeur - Adjoint : M. DEGUEURCE Christophe, Professeur
-UNITE D’ANATOMIE DES ANIMAUX DOMESTIQUES
Mme CREVIER-DENOIX Nathalie, Professeur*
M. DEGUEURCE Christophe, Professeur
Mlle ROBERT Céline, Maître de conférences
M. CHATEAU Henri, AERC
-UNITE DE PATHOLOGIE GENERALE , MICROBIOLOGIE,
IMMUNOLOGIE
Mme QUINTIN-COLONNA Françoise, Professeur*
M. BOULOUIS Henri-Jean, Professeur
-UNITE DE PHYSIOLOGIE ET THERAPEUTIQUE
M. BRUGERE Henri, Professeur *
Mme COMBRISSON Hélène, Professeur
M. TIRET Laurent, Maître de conférences
-UNITE DE PHARMACIE ET TOXICOLOGIE
Mme ENRIQUEZ Brigitte, Professeur *
Mme HUYNH-DELERME, Maître de conférences contractuel
M. TISSIER Renaud, Maître de conférences
-UNITE DE BIOCHIMIE
M. BELLIER Sylvain, Maître de conférences*
M. MICHAUX Jean-Michel, Maître de conférences
- UNITE D’HISTOLOGIE , ANATOMIE PATHOLOGIQUE
M. CRESPEAU François, Professeur *
M. FONTAINE Jean-Jacques, Professeur
Mme BERNEX Florence, Maître de conférences
Mme CORDONNIER-LEFORT Nathalie, Maître de conférences
- UNITE DE VIROLOGIE
M. ELOIT Marc, Professeur *
Mme ALCON Sophie, Maître de conférences
-DISCIPLINE : PHYSIQUE ET CHIMIE BIOLOGIQUES ET
MEDICALES
M. MOUTHON Gilbert, Professeur
-DISCIPLINE : BIOLOGIE MOLECULAIRE
Melle ABITBOL Marie, Maître de conférences contractuel
-DISCIPLINE : ETHOLOGIE
M. DEPUTTE Bertrand, Professeur
-DISCIPLINE : ANGLAIS
Mme CONAN Muriel, Ingénieur Professeur agrégé certifié
DEPARTEMENT D’ELEVAGE ET DE PATHOLOGIE DES EQUIDES ET DES CARNIVORES (DEPEC)
Chef du département : M. FAYOLLE Pascal, Professeur - Adjoint : M. POUCHELON Jean-Louis , Professeur
-UNITE DE MEDECINE
M. POUCHELON Jean-Louis, Professeur*
Mme CHETBOUL Valérie, Professeur
M. MORAILLON Robert, Professeur
M. BLOT Stéphane, Maître de conférences
M. ROSENBERG Charles, Maître de conférences
Melle MAUREY Christelle, Maître de conférences contractuel
-UNITE D’OPHTALMOLOGIE
M. CLERC Bernard, Professeur
Melle CHAHORY Sabine, Maître de conférences contractuel
- UNITE DE CLINIQUE EQUINE
M. DENOIX Jean-Marie, Professeur *
M. AUDIGIE Fabrice, Maître de conférences
Mme CARSTANJEN Bianca, Maître de conférences contractuel
Mme DESJARDINS-PESSON Isabelle, Maître de confér..contractuel
Mme GIRAUDET Aude, Professeur contractuel
-UNITE DE REPRODUCTION ANIMALE
M. MIALOT Jean-Paul, Professeur * (rattaché au DPASP)
M. NUDELMANN Nicolas, Maître de conférences
Mme CHASTANT-MAILLARD Sylvie, Maître de conférences
(rattachée au DPASP )
M. FONTBONNE Alain, Maître de conférences
M. REMY Dominique, Maître de conférences (rattaché au DPASP)
Melle CONSTANT Fabienne, AERC (rattachée au DPASP)
- UNITE DE PATHOLOGIE CHIRURGICALE
M. FAYOLLE Pascal, Professeur *
M. MAILHAC Jean-Marie, Maître de conférences
M. MOISSONNIER Pierre, Professeur
Mme VIATEAU-DUVAL Véronique, Maître de conférences
M. DESBOIS Christophe, Maître de conférences
Mlle RAVARY Bérangère, AERC (rattachée au DPASP)
M. ZILBERSTEIN Luca, Maître de conférences contractuel
M. HIDALGO Antoine, Maître de conférences contractuel
- UNITE DE RADIOLOGIE
Mme BEGON Dominique, Professeur*
M. RUEL Yannick, AERC
- UNITE DE PARASITOLOGIE ET MALADIES PARASITAIRES
M. CHERMETTE René, Professeur *
M. POLACK Bruno, Maître de conférences
M. GUILLOT Jacques, Professeur
Melle MARIGNAC Geneviève, Maître de conférences contractuel
M. PARAGON Bernard, Professeur (rattaché au DEPEC)
M. GRANDJEAN Dominique, Professeur (rattaché au DEPEC)
Melle BLANCHARD Géraldine, Professeur contractuel
DEPARTEMENT DES PRODUCTIONS ANIMALES ET DE LA SANTE PUBLIQUE (DPASP)
Chef du département : M. CERF Olivier, Professeur - Adjoint : M. BOSSE Philippe, Professeur
-UNITE DES MALADIES CONTAGIEUSES
M. BENET Jean-Jacques, Professeur*
M. TOMA Bernard, Professeur
Mme HADDAD H0ANG XUAN Nadia, Maître de confér.contractuel
Mme DUFOUR Barbara, Maître de conférences
M. SANAA Moez, Maître de conférences
-UNITE D’HYGIENE ET INDUSTRIE DES ALIMENTS
D’ORIGINE ANIMALE
M. BOLNOT François, Maître de conférences *
M. CARLIER Vincent, Professeur
M. CERF Olivier, Professeur
Mme COLMIN Catherine, Maître de conférences
M. AUGUSTIN Jean-Christophe, Maître de conférences
- UNITE DE ZOOTECHNIE, ECONOMIE RURALE
M. COURREAU Jean-François, Professeur*
M. BOSSE Philippe, Professeur
Mme GRIMARD-BALLIF Bénédicte, Professeur
Mme LEROY Isabelle, Maître de conférences
M. ARNE Pascal, Maître de conférences
M. PONTER Andrew, Maître de conférences
- UNITE DE PATHOLOGIE MEDICALE DU BETAIL ET DES
ANIMAUX DE BASSE-COUR
M. MILLEMANN Yves, Maître de conférences*
Mme BRUGERE-PICOUX Jeanne, Professeur
M.MAILLARD Renaud, Maître de conférences contractuel
M. ADJOU Karim, Maître de conférences
Mme CALAGUE
,
Professeur d’Education Ph
y
si
q
ue * Res
p
onsable de l’Unité AERC : Assistant d’Ensei
g
nement et de Recherche Contractuel

Remerciements
A Monsieur le Professeur de la Faculté de Médecine de Créteil,
Pour nous avoir fait l’honneur d’accepter la présidence de notre jury de thèse,
Hommage respectueux.
A Monsieur Rosenberg,
Maître de Conférences à l’Ecole Nationale Vétérinaire d’Alfort,
Pour sa participation décisive dans l’évolution de mes études au cours de ces
dernières années, notamment par ce travail mais dans bien d‘autres occasions aussi.
Profonds remerciements.
A Madame Delisle, Monsieur Devauchelle et Madame Segond,
Pour leur confiance et l’ensemble des données à la base de ce travail.
Sincères remerciements.
A Madame Alcon,
Maître de Conférences à l’Ecole Nationale Vétérinaire d’Alfort,
Pour avoir eu la gentillesse de corriger ce travail et de participer à notre jury de thèse.
Sincères remerciements.
Aux enseignants que j’ai rencontrés au cours de mes études et qui ont su me
transmettre leurs connaissances quelles que soient mes difficultés. Leur patience et
leur respect envers les élèves sont des qualités d’autant plus précieuses qu’elles
peuvent être rares, sans lesquelles ma formation n’aurait pu être possible.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
 58
58
 59
59
 60
60
 61
61
 62
62
 63
63
 64
64
 65
65
 66
66
 67
67
 68
68
 69
69
 70
70
 71
71
 72
72
 73
73
 74
74
 75
75
 76
76
 77
77
 78
78
 79
79
 80
80
 81
81
 82
82
 83
83
 84
84
 85
85
 86
86
 87
87
 88
88
 89
89
 90
90
 91
91
 92
92
 93
93
 94
94
 95
95
 96
96
 97
97
 98
98
 99
99
1
/
99
100%