activation de fonction : les alcools

TD#Chapitre#17#:#Activation#de#fonction#:#les#alcools############################################################################################################PCSI#
TD#CHAPITRE#17#:#ACTIVATION#DE#FONCTION#:#LES#ALCOOLS#
!
Ce!qu’il!faut!savoir!:!!
Nécessité#de#l’activation#électrophile#et#nucléophile#des#alcools#
Comment#former#un#alcoolate#?##
Bilan,#caractéristiques#et#mécanisme#des#réactions#suivantes#:##
• Synthèse#de#Williamson#
• Déshydratation#intramoléculaire#d’un#alcool#tertiaire#(E1)#
• Compétition#avec#la#déshydratation#intermoléculaire#pour#les#alcools#primaire#ou#secondaire#(SN2)#
• Synthèse#d’un#dérivé#halogéné#par#réaction#d’un#alcool#avec#un#halogénure#d’hydrogène#HX.#
Formation#d’esters#sulfoniques#:#bilan#et#intérêt.#
Ce!qu’il!faut!savoir!faire!:!
Choisir#une#base#pour#déprotoner#un#alcool#ou#un#phénol#à#partir#d’une#échelle#de#pKA#
Prévoir#la#réactivité#d’un#alcool#selon#les#conditions#opératoires.#
Prévoir#le#produit#majoritaire#d’une#réaction#(régiosélectivité,#stéréosélectivité,#ou#compétition#entre#deux#réactions).#
Commenter#dans#une#synthèse#le#choix#d’une#activation#in#situ#par#protonation#ou#par#passage#par#un#tosylate.#
Repérer#dans#une#synthèse#les#étapes#de#protection#et#de#déprotection#des#alcools.#
#
Exercice!1!:!Indiquer!les!réponses!exactes!
1)#a)#HO−#est#un#bon#groupe#partant####b)#H2O#est#un#bon#groupe#partant####c)#TsO−#est#un#mauvais#groupe#partant.#
#####d)#Les#bases#conjuguées#de#H2SO4#et#H3PO4#sont#de#bons#nucléophiles.#
2)#a)#Une#déshydratation#intramoléculaire#fournit#un#alcène.##
####b)#Une#déshydratation#intermoléculaire#fournit#un#étheroxyde.#
3)#a)#La#protonation#d’un#alcool#en#milieu#acide#permet#une#activation#nucléophile#du#groupe#hydroxyle.#
#####b)#La#réaction#d’un#halogénure#d’hydrogène#HX#sur#un#alcool#ROH#en#milieu#basique#donne#un#dérivé#halogéné#RX.#
!
Exercice!2!:!Faire!le!point!
Compléter# les# schémas# de# réactions# suivants.# Si# plusieurs# produits# sont# possibles,# indiquer# celui# obtenu# majoritairement#et#
donner#le#mécanisme#correspondant#:##
1) 1-méthylcyclohexan-1-ol,#chauffé#en#présence#d’acide#phosphorique#à#…#
2) butan-1-ol,#chauffé#à#60°C#en#présence#d’acide#sulfurique#à#…#
3) 1-chlorobutane#+#propan-2-olate#de#sodium#à#…#
4) 2-méthyl-2-iodopropane#+#éthanolate#de#sodium#à#…#
5) propan-1-ol#+#bromure#d’hydrogène#à…#
6) Cyclohexanol#+#TsCl#en#présence#de#pyridine#à…#puis#ajout#de#KI#(K+I-)#à#…#
#
Exercice!3!:!Rétrosynthèses!d’étheroxydes!
Déterminer#l’alcoolate#et#le#dérivé#bromé#R-Br#permettant#la#synthèse#des#composés#suivants.#Dans#le#cas#où#deux#combinaisons#
sont#envisageables,#préciser#la#méthode#la#plus#judicieuse.#
1) Ethoxyéthane#########2)#1-éthoxybutane#######3)#Ethoxybenzène########4)#Méthoxycyclopentane#
5) Quelle#que#soit#la# classe#de# l’alcoolate,#sa# réaction#sur#le#2-iodo-2-méthylpropane#conduit#à#un#alcène.#Expliquer#en#
précisant#le# mécanisme#de#la# réaction.#Comment#obtenir# alors#: # ?#
!
Exercice!4!:!activation!in#situ!d’alcool!
Le#butan-2-ol#est#un#alcool#utilisé#comme#solvant,#mais#aussi#comme#intermédiaire#de#synthèse.#
1)# Afin# d’obtenir# le# but-2-ène# à# partir# du# (R)-butan-2-ol,# on# chauffe# une# solution# de# (R)-butan-2-ol# en# présence# d’acide#
sulfurique.#On#obtient#le#résultat#suivant#:#
Expliquer# les# proportions# relatives# des# différents# produits# et# donner# le#
mécanisme#de#la#réaction.#
2)# Le# (R)-butan-2-ol# est# maintenant# traité# par# une# solution# d’acide#
chlorhydrique#:#on#observe#la#formation#de#deux#stéréoisomères#de#configuration#notés#B#et#C,#de#formule#brute#C4H9Cl.#
#a)#Représenter#les#deux#stéréoisomères#obtenus#en#représentation#de#Cram.#
b)#Donner#le#mécanisme#détaillé.#
c)#Le#milieu#final#est-il#optiquement#actif#?#Justifier.#

TD#Chapitre#17#:#Activation#de#fonction#:#les#alcools############################################################################################################PCSI#
Exercice!5!:!Utilisation!d’esters!sulfoniques!
1. Quel#est#le#produit#de#la#séquence#de#réactions#suivantes,#sachant#que#la#2e#étape#a#lieu#en#
un#seul#acte#élémentaire#?#Préciser#sa#stéréochimie.##
#
2.#On#étudie#la#séquence#réactionnelle#suivante#:##
a)#Donner#la#formule#de#B.#
b)#Par#analogie#avec#les#alcools,#proposer#une#structure#pour#D,#issu#de#la#
réaction#entre#NaH#et#le#thiol#proposé.#
c)#Donner#le#mécanisme#de#la#dernière#étape.#À#quelle#réaction#de#ce#
chapitre#cette#séquence#réactionnelle#fait-elle#penser#?# #
#############Donnée#:#pKa#(thiol#RSH#/#thiolate#RS—)#=#10#
3. Au#cours#de#la#synthèse#d’un#antitumoral,#la#(+)-muconine,#on#rencontre#la#transformation#suivante#:##
!
a) Ecrire#le#produit#de#la#première#étape#et#interpréter#la#régiosélectivité.##
b) Donner#le#mécanisme#de#la#deuxième#étape.#
!
Exercice!6!:!Synthèse!d’époxyde!
On#appelle#époxydes#les#molécules#suivantes#:##!
Une#préparation#d’époxyde#consiste#à#traiter,#à#température#ambiante,#un#β-halogénoalcool#en#milieu#basique#dilué.#Il#se#forme#
un#anion#qui#subit#une#réaction#intramoléculaire#de#type#SN2.##
1. Ecrire#le#mécanisme#dans#le#cas#du#2-bromoéthan-1-ol#en#présence#de#soude.##
2. Représenter#les#produits#obtenus#et#commenter#la#sélectivité#de#la#réaction#à#partir#du#(3S,#2S)-3-chlorobutan-2-ol#en#
présence#de#soude.##
#
Exercice!7!:!Protection!des!alcools!
1)#Identifier#les#produits#A,#B,#C#et#D#de#la#suite#de#réactions#ci-dessous.##
!
2) Donner#le#mécanisme#des#trois#premières#étapes.##
3) Mettre# les# flèches# dans# le# mécanisme# ci-dessous,# correspondant# à# la# dernière# étape.# Nommer# les# différents# actes#
élémentaires.##
#
4) Expliquer#l’utilité#de#la#première#étape.#
!
Exercice!8!:!Passage!d’un!alcool!à!une!amine#
1. La#réaction#directe#de#SN#de#l’ammoniac#sur#le#propan-1-ol#est#impossible.#Pourquoi#?#
2. Proposer#un#schéma#en#deux#étapes#permettant#la#synthèse#du#1-aminopropane#à#partir#du#propan-1-ol.#
Donnée#:#pKA(NH4
+/NH3)#=#9,2#
#
Exercice!9!:!Synthèses!à!imaginer!
On#pourra#s’appuyer#sur#le#document#1#de#la#page#suivante.#
1) En#utilisant#tous#les#réactifs#utiles,#proposer#une#méthode#pour#transformer#le#propan-1-ol#en#butan-1-ol.#
2) En#utilisant#tous#les#réactifs#utiles,#proposer#une#méthode#pour#transformer#le#propan-1-ol#en#butan-2-ol.#
3) A#partir#d’éthanol,#de#tout#réactif#inorganique*#et#de#tout#solvant,#proposer#une#synthèse#de#la#butanone.#
*#Un#réactif#inorganique#ne#contient#pas#à#la#fois#des#atomes#de#carbone#et#d’hydrogène.#
#
#
#
#
OCOOH +HIOCOOH +I
H
OCOOH +I
H
CH3
OH
A
B
TsCl
pyridine
_
_
SH
_
_
NaH DBS
_
_
+ TsO-
OH
1) CH3SO2Cl
2) NaI ?
_
_
Na+, I-

TD#Chapitre#17#:#Activation#de#fonction#:#les#alcools############################################################################################################PCSI#
Document!1!:!Oxydation!des!alcools!
Les#alcools#(primaires#et#secondaires)#peuvent#être#oxydés#en#aldéhydes,#cétones,#acides#carboxyliques#
#
Quel#oxydant#utiliser#?##
Oxydants# à# base# de# chrome# (CrO3,# Cr2O72-#…),#
permanganate#(MnO4-)…#
Exemple#:#
#
Attention#!# Pour# oxyder# un# alcool# primaire# en#
aldéhyde,#il#ne#pas#utiliser#un#oxydant#trop#fort,#sinon#l’aldéhyde#obtenu#est#oxydé#à#son#tour,#et#on#obtient#l’acide#carboxylique.#
Exemple#:##
!
!
Résolution!de!problème!:!le!réarrangement!de!carbocation!
Document!2!:##
!
#
Le#réarrangement#de#carbocation#se#fait#le#plus#
souvent#par#déplacement#(migration)#d’un#
hydrogène#ou#d’un#groupe#alkyle.#
!
Document!3!:!le!réarrangement!de!Wagner-Meerwein!
!
#
La#migration#d’un#groupe#alkyle#vers#un#centre#
cationique#est#appelée#réarrangement#de#
Wagner-Meerwein.#
Document!4!:!le!réarrangement!pinacolique!
#
Question!1!:!comment#justifier#qu’un#carbocation#ait#tendance#à#se#réarranger#?!
Question!2!:!donner#les#mécanismes#du#réarrangement#de#Wagner-Meerwein#et#du#réarrangement#pinacolique.#
!
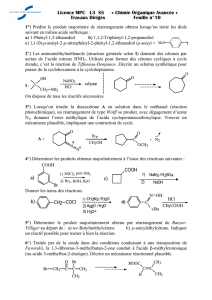
A!rendre!:!Exercice!10!:!Quelques!réactions!des!alcools!
On#s’intéresse#à#l’un#des#stéréoisomères#de#configuration#du#2-isopropylcyclohexan-1-ol,#noté#A.##
1. #Dessiner#A#dans#sa#conformation#la#plus#stable.#
2. Combien#de#stéréoisomères#de#configuration#le#2-isopropylcyclohexan-1-ol#possède-t-il#?#Préciser#
le#stéréodesripteur#des#atomes#de#carbone#asymétriques#du#stéréoisomère#A.#
3. Cet# alcool# A# a# été# obtenu# par# action# d’une# solution# aqueuse# d’hydroxyde# de# sodium# sur# un# dérivé# bromé# d’un#
cycloalcane,# par# réaction# d’ordre# partiel# égal# à# un# par# rapport# aux# ions# hydroxyde.# Donner,# en# la# justifiant,# la#
représentation#topologique#de#ce#dérivé#bromé#(en#précisant#la#stéréochimie).#
4. L’alcool#A#est#à#présent#chauffé#en#présence#d’acide#sulfurique#H2SO4#concentré,#en#milieu#aqueux.#Il#se#forme#alors#un#
mélange#de#deux#composés#de#formule#brute#C9H16.##
a)#Donner#la#formule#plane#topologique#de#ces#deux#composés.#Lequel#est#majoritaire#?#Pourquoi#?#
b)#Proposer#un#mécanisme#détaillé#pour#l’obtention#du#produit#majoritaire.##
c)#Dans#le#spectre#infrarouge,#une#bande#à#3300#cm—1#disparaît#et#une#bande#à#1650#cm—1#apparaît.#Expliquer.#
d)#Pourquoi#n’utilise-t-on#pas#de#l’acide#chlorhydrique#à#la#place#de#l’acide#sulfurique#?#
5. L’alcool# A# est# maintenant# traité# par# une# solution# d’acide# chlorhydrique# :# on# observe# la# formation# de# deux#
stéréoisomères#de#configuration#notés#B#et#C,#de#formule#brute#C9H17Cl.#
a)#Représenter#les#deux#stéréoisomères#obtenus#en#représentation#de#Cram#et#en#représentation#chaise.#On#précisera#pour#
chacun#la#conformation#la#plus#stable.#Quelle#est#la#relation#d’isomérie#exacte#entre#B#et#C#?#
H
H
déplacement d'un hydrogène déplacement d'un groupe alkyle
OH
_
_
HBr Br
_
_
_
HO OH
_
_
_
_
H2SO4O
_
_
pinacol pinacolone
Réactif(de(Jones(

TD#Chapitre#17#:#Activation#de#fonction#:#les#alcools############################################################################################################PCSI#
b)#Donner#le#mécanisme#détaillé.##
c)#Le#milieu#final#est-il#optiquement#actif#?#Justifier.#
6.# A# est# traité# par# de# l’hydroxyde# de# potassium# K+,HO-#puis# mis# en# présence# d’iodure# de# méthyle# pour# donner# D# (C10H20O).#
Représenter#D#ainsi#que#le#mécanisme#de#sa#formation.#Quel#type#d’activation#est#utilisé#ici#?#
7.##A#est#mis#en#présence#de#chlorure#de#mésyle#MsCl#et#de#pyridine#pour#donner#E.#Mis#en#présence#d’hydrure#de#sodium#NaH,#E#
donne# deux# composés# F# et# F’# présentant# chacun# 2# insaturations# et# une# bande# infrarouge# à# 1650# cm-1.# Le# composé# F# est#
majoritaire.##
a)#Identifier#E,#F#et#F’.#Donner#les#mécanismes#de#formation#de#F#et#F’.#Comparer#à#la#question#4.#
b)#Quel#type#d’activation#de#la#fonction#hydroxyle#est#utilisé#ici#?#
#
APPROCHE#DOCUMENTAIRE#:#DIFFERENTS#MODES#DE#PROTECTION#DES#ALCOOLS#
Dans!ces!deux!synthèses!multi-étapes,!identifier!les!étapes!de!protection!et!déprotection!de!groupes!hydroxyle.!Justifier!la!
nécessité!de!ces!protections.!Calculer!le!rendement!de!la!synthèse!du!document!1!et!commenter.!!
Document!1!:!Extrait!de!la!synthèse!totale!de!la!gilvocarcine!par!Suzuki!(1992)#
O
Ph
O
OH
1. CH3OCH2Cl, Et3N
(r = 100%)
2. NaOH aq.
(r = 100%)
OH
OO APTS
(r = 95%)
O
O
OO
O
BuLi, I2
(r = 90%)
O
O
O
O
I
APTS, EtOH
(r = 90%)
OH
OO
I
NaH,
PhCH2Br (r = 98%)
O
OO
I
Ph HCl 4M (aq.)
MeOH
(r = 97%)
O
OH
I
Ph
!
#
Document!2!:!Extrait!de!la!synthèse!totale!de!la!rapamycine!par!Nicolaou!(1993)#
O
OH
NaH
PhCH2Br
(r = 95%)
O
OBn
APTS (cat.)
MeOH
(r = 90%) OH
OBn
OMe
t-Bu
Si
O
SCF3
O
O
pyridine
O
OBn
OMe
Si
t-Bu
H2, Pd/C
(r = 89% sur 2 Ètapes)
O
OH
OMe
Si
t-Bu
CrO3
pyridine
(r = 92%)
O
O
OMe
Si
t-Bu HF aqueux
(r = 95%) OH
O
OMe
!
#
1
/
4
100%