ouvrir - B. Braun

HAS - Direction de l'Evaluation Médicale, Economique et de Santé Publique
1/5
Avis 2
COMMISSION DE LA TRANSPARENCE
Avis
2 décembre 2015
chrome, cuivre, fer, fluor, iode, manganèse, molybdène, sélénium,
zinc
TRACUTIL, solution à diluer pour perfusion
B/5 ampoules de 10 ml (CIP : 34009 355 652 5 9)
Laboratoire B BRAUN MEDICAL
DCI chrome, cuivre, fer, fluor, iode, manganèse, molybdène, sélénium, zinc
Code ATC (2015) B05XA (Solutions d’électrolytes)
Motif de l’examen Modification des conditions d’inscription suite aux modifications du RCP
Listes concernées
Sécurité Sociale (CSS L.162-17)
Collectivités (CSP L.5123-2)

HAS - Direction de l'Evaluation Médicale, Economique et de Santé Publique
2/5
Avis 2
01
I
NFORMATIONS ADMINISTRATIVES ET REGLEMENTAIRES
AMM (procédure
nationale)
Date initiale (procédure de reconnaissance mutuelle, pays rapporteur :
Allemagne) : 18 décembre 2000
Rectificatif : 17/07/2014
Conditions de
prescription et de
délivrance / statut
particulier
Liste I
Conditions actuelles
de prise en charge Sécurité Sociale : 65 %
Collectivités
02
C
ONTEXTE
L’ANSM a actualisé le RCP de cette spécialité dans le cadre de son renouvellement quinquennal
et a inscrit TRACUTIL sur liste I à l’instar des autres produits contenant du fer et administrés par
voie parentérale.
03
M
ODIFICATIONS APPORTEES
Les modifications du RCP sont présentées en annexe. Elles concernent notamment des
précisions sur la grossesse, l’allaitement et les effets indésirables.
04
C
ONCLUSIONS DE LA
C
OMMISSION
La Commission prend acte de ces modifications qui ne sont pas de nature à modifier ses
précédentes évaluations.

HAS - Direction de l'Evaluation Médicale, Economique et de Santé Publique
3/5
Avis 2
ANNEXE
ANCIEN RCP RCP ACTUEL
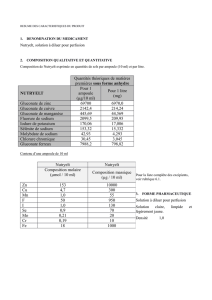
2. COMPOSITION QUALITATIVE ET QUANTITATIVE 2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Excipient à effet notoire :
Chaque ampoule de 10 ml contient
147 micromoles (ou 3,4 mg) de
sodium.
3. FORME PHARMACEUTIQUE
Solution à diluer pour perfusion.
3. FORME PHARMACEUTIQUE
Solution à diluer pour perfusion.
Solution aqueuse claire et limpide.
pH = 1,7 à 2,3
Osmolarité maximale théorique : environ 90 mOsm/l
4.2. Posologie et mode d'administration
Réservé à l'adulte.
Posologie
La posologie quotidienne recommandée est de 10 ml (1 ampoule) pour les
patients à besoins standards.
Pour les patients à besoins modérément augmentés, la dose quotidienne
peut aller jusqu'à 20 ml (2 ampoules), en surveillant les concentrations
sériques en oligo-éléments.
En cas d'augmentation importante des besoins en oligo-éléments (brûlures
étendues, polytraumatisés, hypercatabolisme sévère), des doses plus
élevées peuvent être nécessaires.
Pour les patients à fonction rénale et/ou hépatique altérée, les doses
doivent être déterminées au cas par cas. Pour ces patients, des doses plus
basses peuvent être nécessaires.
4.2. Posologie et mode d'administration
Réservé à l'adulte.
Posologie
La posologie quotidienne recommandée est de 10 ml (1 ampoule) pour les
patients à besoins standards.
Pour les patients à besoins modérément augmentés, la dose quotidienne
peut aller jusqu'à 20 ml (2 ampoules), en surveillant les concentrations
sériques en oligo-éléments.
En cas d'augmentation importante des besoins en oligo-éléments (brûlures
étendues, polytraumatisés, hypercatabolisme sévère), des doses plus
élevées peuvent être nécessaires.

HAS - Direction de l'Evaluation Médicale, Economique et de Santé Publique
4/5
Avis 2
Mode d'administration
TRACUTIL est une solution concentrée d'oligo-éléments, qui ne doit être
administrée par voie intraveineuse qu'après dilution dans au moins 250 ml
d'une solution pour perfusion compatible, par exemple une solution
glucosée (à 5 % ou 10 %), une solution d'électrolytes (par exemple:
chlorure de sodium à 0,9 %, solution de Ringer).
La compatibilité doit être testée avant mélange à d'autres solutions pour
perfusion.
La durée de perfusion du mélange prêt à l'emploi ne doit pas être inférieure
à 6 heures et ne doit pas se prolonger au delà de 24 heures.
L'administration peut être poursuivie pendant la durée de la nutrition
parentérale.
Pour les incompatibilités et les instructions pour l'utilisation, voir rubriques
6.2 et 6.6.
Remarques
Une diarrhée peut conduire à une augmentation des pertes intestinales en
zinc.
Dans ce cas, il faut surveiller les concentrations sériques.
Des carences en oligo-éléments donnés doivent être corrigées par une
supplémentation spécifique.
Population pédiatrique
TRACUTIL est contre-indiqué chez les nouveau-nés, les nourrissons et les
enfants ( voir rubrique 4.3)
TRACUTIL est déconseillé chez les adolescents (voir rubrique 4.4)
Patients présentant une insuffisance rénale et hépatique
Pour les patients présentant une fonction rénale et/ou hépatique altérée, les
doses doivent être déterminées au cas par cas. Pour ces patients, des
doses plus faibles peuvent être nécessaires.
Mode d'administration
TRACUTIL est une solution concentrée d'oligo-éléments, qui ne doit être
administrée par voie intraveineuse qu'après dilution dans au moins 250 ml
d'une solution pour perfusion compatible, par exemple :
- une solution glucosée (à 5 % ou 10 %),
- -une solution d'électrolytes (par exemple: chlorure de sodium à 0,9
%, solution de Ringer).
La compatibilité doit être testée avant mélange à d'autres solutions pour
perfusion.
La durée de perfusion du mélange prêt à l'emploi ne doit pas être inférieure
à 6 heures et ne doit pas se prolonger au delà de 24 heures.
L'administration peut être poursuivie pendant la durée de la nutrition
parentérale.
Pour les incompatibilités et les instructions pour l'utilisation, voir rubriques
6.2 et 6.6.
Remarques
Une diarrhée peut conduire à une augmentation des pertes intestinales en
zinc.
Dans ce cas, il faut surveiller les concentrations sériques.
Des carences en oligo-éléments donnés doivent être corrigées par une
supplémentation spécifique.
4.3. Contre-indications
4.3. Contre-indications
•
Hypersensibilité aux substances actives ou à l'un des
excipients mentionnés à la rubrique 6.1.
•
Cholestase prononcée (
bilirubine sérique > 140 mmol/l et augmentation
de la
gamma-glutamyltransférase
et des phosphatases alcalines).
•
M
alad
ie de
Wilson
et anomalies de stockage du fer (par
exemple hémosidérose ou hémochromatose).

HAS - Direction de l'Evaluation Médicale, Economique et de Santé Publique
5/5
Avis 2
•
TRACUTIL est contre-indiqué chez les nouveau-nés , les nourrissons et
les enfants car sa composition est inappropriée pour ce groupe d'âge.
4.6. Grossesse et allaitement
Pour TRACUTIL, il n'y a aucune donnée clinique disponible sur l'exposition
chez la femme enceinte et la femme allaitante.
Il n'y a pas eu d'études de toxicité sur la reproduction et le développement
chez l'animal avec TRACUTIL.
Ainsi, TRACUTIL ne devrait pas être utilisé pendant la grossesse et
l'allaitement sauf après examen approfondi du rapport bénéfice/risques.
4.6. Grossesse et allaitement
Grossesse
Il n'existe pas de données ou il existe des données limitées sur
l'utilisation de TRACUTIL chez la femme enceinte. Il n'y a pas eu
d'études de toxicité sur la reproduction et le développement chez l'animal
avec TRACUTIL (voir section 5.3). TRACUTIL ne devrait pas être utilisé
pendant la grossesse sauf si l'état clinique de la femme nécessite un
traitement avec TRACUTIL.
Allaitement
On ne sait pas si les substances actives/métabolites de TRACUTIL sont
excrété(e)s dans le lait maternel. Ainsi, TRACUTIL ne devrait pas être
utilisé pendant la grossesse et l'allaitement sauf après examen
approfondi du rapport bénéfice attendu pour la mère et des risques
potentiels pour l'enfant.
Fécondité
Aucune donnée disponible
4.8. Effets indésirables
Des cas isolés de réactions anaphylactiques au fer administré par voie
parentérale, allant jusqu'au décès, ont été rapportés.
L'iode peut créer des réactions allergiques.
4.8. Effets indésirables
Affections du système immunitaire :
Fréquence indéterminé (ne peut être estimé
sur la base des données disponibles)
:
- Réactions anaphylactiques au fer administré par voie parentérale ,
pouvant aller jusqu'au décès .
- L'iode peut aussi créer des réactions allergiques .
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
1
/
16
100%