tracitrans

Disponible auprès des grossistes répartiteurs
Non listé
Remboursement SS : 65 %
SMR Important dans les situations nécessitant une nutrition parentérale (cancer, SIDA, maladies inflamma-
toires du tractus digestif…)
ASMR De niveau V (pas d’amélioration) par rapport aux solutions injectables d’oligo-éléments actuellement
commercialisées
1. Conditions de prescription et de délivrance
Mentions réglementaires
Produit non listé
Pas de conditions particulières de dispensation ou de prescription
Contre-indications
Chez l’enfant
Chez les patient de poids corporel inférieur à 40 kg
Cholestase prononcée (taux sanguin de la bilirubine > 140 µmol/l)
Hypersensibilité connue à l’un des principes actifs, en particulier fer et iode, ou à l’excipient
Maladie de Wilson et hémochromatose, ou taux sanguin élevé de l’un des constituants de Tracitrans®
Excipient à effet notoire : Hydroxyde de sodium
Interactions médicamenteuses
Ne pas ajouter Tracitrans®à des solutions pour perfusion contenant des phosphates inorganiques (risque de précipitation)
SORTIE DE LA RÉSERVE HOSPITALIÈRE - 2004
TRACITRANS®
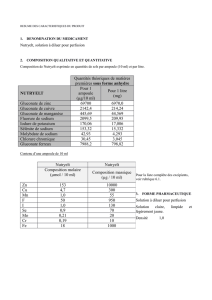
Manganèse (chlorure de) tetrahydrate, sodium (selenite de) pentahy-
drate, chromique (chlorure) hexahydrate, sodium (molibdate de) dihy-
drate, ferrique (chlorure) hexahydrate cuivre (chlorure de) dihydrate,
potassium (iodure de), sodium (fluorure de), zinc (chlorure de)
1
TRACITRANS®, solution à diluer pour perfusion, 10 ampoules de 10 ml 30,90 € 354 016.8
Présentation Prix AMM
Tracitrans®, solution à diluer pour perfusion est indiquée comme apport en oligo-éléments dans le cadre d’un protocole nutrition-
nel par voie intraveineuse pour couvrir les besoins de base au cours de la nutrition parentérale.
Cette présentation est réservée à l’adulte.
Les situations nécessitant la mise en place d’une nutrition parentérale sont diverses et présentent en général un caractère de gra-
vité (cancer, sida, maladies inflammatoires du tractus digestif, brûlures étendues, patients gravement traumatisés présentant un hy-
percatabolisme important).
Commercialisation en ville : octobre 2006

Grossesse et allaitement
Tracitrans®ne doit être utilisé que si nécessaire (absence de données)
Précautions d’emploi
Ne jamais administrer Tracitrans®non dilué
Avant utilisation, inspecter visuellement la solution reconstituée. N’utiliser qu’une solution transparente et exempte de par-
ticules
Lors de la préparation du mélange, se conformer à des conditions rigoureuses d’asepsie, s’assurer de l’homogénéité du
mélange et de l’absence d’incompatibilité
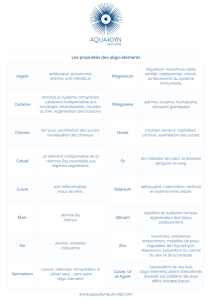
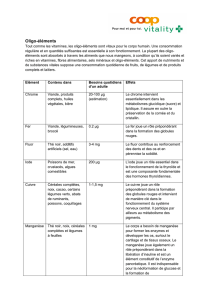
En cas de nutrition parentérale prolongée : Faire un suivi régulier du taux sanguin de manganèse. Une réduction de dose
ou l’arrêt du traitement peuvent être nécessaires si le taux de manganèse s’élève pour atteindre un taux potentiellement
toxique
Un risque de surdosage en fer peut être observé chez les patients recevant des transfusions sanguines répétées
Toute solution non utilisée (avant ou après mélange) d’une ampoule ouverte doit être jetée
En pratique
Aminomix®peut être remis dans un emballage ordinaire
2. Conseils au patient
Posologie et plan de prise
Cette présentation est réservée à l’adulte
La posologie usuelle recommandée est de 10 ml par jour (1 ampoule)
En cas de besoins significativement augmentés en oligo-éléments (brûlures étendues, patients gravement traumatisés…),
la posologie peut être de 2 ampoules par jour (20 ml), avec contrôle du taux sanguin des oligo-éléments
Adaptation posologique
Adapter la posologie des patients présentant des troubles de la fonction hépatique ou une cholestase modérée (pouvant
gêner l’élimination biliaire du manganèse, du cuivre et du zinc, et entraîner une accumulation et un surdosage en manga-
nèse, cuivre et zinc)
Adapter la posologie des patients présentant des troubles de la fonction rénale : L‘excrétion de certains oligo-éléments (sélé-
nium, fluor, molybdène et zinc) pouvant être significativement diminuée, le risque d’accumulation est possible
Modalités d’administration
Voie intraveineuse, après dilution
Avant utilisation, vérifier que la solution est homogène et que l’ampoule est indemne ou exempte de fêlures ou d’éclats
Cette solution n’est pas destinée à être administrée telle quelle. Elle doit être diluée en tenant compte de l’osmolarité finale
désirée
Tracitrans®peut être dilué ou incorporé à un mélange nutritif (binaire ou ternaire) ou dans une solution de glucose, en agi-
tant doucement le mélange dans des conditions rigoureuses d’asepsie
En cas de dilution dans des solutions de glucose à une concentration supérieure à 20 %, la dilution doit tenir compte de l’os-
molarité finale
Tracitrans®peut aussi être ajouté tel quel dans des mélanges de nutrition parentérale. Dans ce cas, vérifier soigneusement
la compatibilité du mélange
Conservation
Avant dilution : Pas de précautions particulières de conservation
Utiliser la solution injectable diluée immédiatement
Suivi thérapeutique
Contrôler le taux sanguin des oligo-éléments
Nutrition parentérale prolongée : Effectuer un suivi régulier du taux sanguin de manganèse. Réduire la dose ou arrêter le
traitement si le taux de manganèse atteint un taux potentiellement toxique
2

3
Effets indésirables
Liste complète – voir RCP
Aucun effet indésirable n’est connu à ce jour ou attendu en cas de respect des conditions d’administration
Quelques cas de réactions anaphylactiques ont été rapportés lors de l’administration de fer par voie veineuse
Protection du patient et son environnement
L’utilisation de Tracitrans®ne requiert pas de mesure spécifique de protection du patient et de son environnement
Gestion des déchets
Conformément à la circulaire de la DHOS du 13/02/06, les déchets ne doivent en aucun cas être déposés aux ordures ménagères
Les médicaments non utilisés (MNU) sont à rapporter à la pharmacie dans leur conditionnement d’origine pour destruction
selon le circuit défini en vigueur
La gestion des déchets est sous la responsabilité du professionnel de santé réalisant l’administration
3. Caractéristiques du médicament
Médicaments à même visée thérapeutique
Ce sont les solutions injectables composées d’électrolytes et d’oligo-éléments indiquées dans le cadre d’un protocole nutri-
tionnel par voie intraveineuse
Place dans la stratégie thérapeutique
Au cours de la nutrition parentérale, l’apport d’oligo-éléments et d’électrolytes est nécessaire pour compléter l’apport pro-
téique et énergétique fourni par les glucides et lipides
Population cible
Pas de données permettant d’estimer le nombre de patients, pris en charge à domicile, devant recevoir un apport en oligo-
éléments dans le cadre d’un protocole nutritionnel par voie intraveineuse
4. Abréviations
Le résumé des caractéristiques du produit (RCP) est disponible sur le site de l’Afssaps : http://afssaps.sante.fr
Les avis de la transparence, comme l’ensemble des publications de la HAS, sont disponibles sur le site de la Haute Autorité
de Santé : www.has-sante.fr
Fresenius Kabi France SA
Tél : 01 41 14 26 00
ASMR
Amélioration du service médical rendu : correspond au progrès thérapeutique apporté par un médicament. La
Commission de la Transparence évalue le niveau d’ASMR, cotée de I (majeure) à IV (mineure). Une ASMR de
niveau V (équivalent à « pas d’ASMR ») signifie « absence de progrès thérapeutique »
MNU Médicament non utilisé
SMR
Service médical rendu : correspond à l’intérêt clinique d’un médicament en fonction de sa place dans la straté-
gie thérapeutique et de son apport en termes de santé publique. La Commission de la Transparence évalue cet
intérêt clinique, qui peut être important, modéré, faible ou insuffisant pour être pris en charge par la collectivité
TTempérature de conservation
1
/
3
100%