corrigé - Chimie PC La Martinière Monplaisir

09 et 16/01/2017 PC2016/2017 – Lycée La Martinière Monplaisir
ORGA TP n°10 – Correction – 1 / 4
TP n°10 – CORRECTION
SYNTHÈSE DE L'ARÔME DE BANANE
Q1 :
acide carboxylique
alcool
ester
Q2 :
acide éthanoïque
3-méthylbutan-1-ol
éthanoate de 3-méthylbutyle
Q3 :
acide éthanoïque :
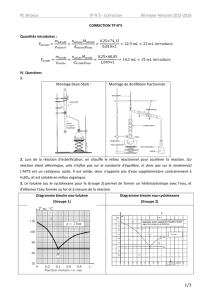
n = d.V/M = 1,05×13/60,1
n = 227 mmol
3-méthylbutan-1-ol :
n = d.V/M = 0,81×20/88,1
n = 184 mmol
Les réactifs sont introduits en proportion quasi-stoechiométrique (l'acide est en léger excès, voir Q6,
une partie de l'acide est aussi entraînée).
Cela ne sert à rien de mettre un réactif en excès puisque l'on va déplacer l'équilibre par retrait d'un
produit.
Q4 :
APTS : Ts-OH
L'APTS est un acide organique (soluble en solvant organique).
Il joue le rôle de catalyseur et sert à protoner l'acide carboxylique afin de rendre le C de COOH plus
OH
O
HO
O
O
OH
O
HO
O
O
S
O
O
OH

09 et 16/01/2017 PC2016/2017 – Lycée La Martinière Monplaisir
ORGA TP n°10 – Correction – 2 / 4
électrophile.
n = m/M = 0,250/190,22
n = 1,3 mmol
L'APTS est en quantité catalytique (facteur 200 environ)
Q5 :
Le milieu réactionnel contient l'acide, l'alcool, l'ester, l'APTS et l'eau. En présence de cyclohexane, l'eau
réalise un hétéroazéotrope avec celui-ci.
Le mélange (riche en cyclohexane) est chauffé, il entre en ébullition à T = 69°C.
La vapeur a la composition de l'hétéroazéotrope (xeau = 0,3), elle monte dans le Dean-Stark puis se
condense dans le réfrigérant.
Le liquide retombe dans la partie burette du Dean-Stark.
Les deux liquides sont non miscibles et l'eau est plus dense que le cyclohexane, ce qui fait que l'excès de
cyclohexane retombe dans le ballon.
Il est possible de mesurer le volume d'eau extrait du milieu réactionnel grâce à la burette.
État du système dans le ballon en ébullition
Q6 :
Le réactif limitant est l'alcool. Au maximum, on forme 184 mmol d'eau.
V = n.M/d = 184.10-4×18/1
V = 3,3 mL
Expérimentalement, on recueille environ 5 mL d'eau.
Ce surplus peut s'expliquer par un entraînement de l'acide éthanoïque (il forme aussi un
hétéroazéotrope avec le cyclohexane et est soluble dans l'eau).
Q7 :
•La phase organique est moins dense que la phase aqueuse donc elle surnage.
•L'acide acétique est très soluble dans l'eau (liaison H), l'alcool l'est peu moins (liaison H mais partie
carbonée importante), l'ester encore moins (liaison H et grande chaîne carbonée).
•L'ester est très soluble dans le cyclohexane (espèces peu polaires), l'alcool et l'acide sont assez peu
solubles dans le cyclohexane (ce sont des espèces polaires, protiques alors que le cyclohexane est
apolaire et aprotique).
Q8 :
La solution de chlorure de sodium est très polaire, elle entraîne l'acide, l'alcool et l'APTS qui sont
dans la phase organique. En revanche, elle entraîne peu l'ester qui est peu polaire.

09 et 16/01/2017 PC2016/2017 – Lycée La Martinière Monplaisir
ORGA TP n°10 – Correction – 3 / 4
Q9 :
L'hydrogénocarbonate est un amphotère. Ici il sert à neutraliser les acides (acétique et APTS, notés AH)
qui restent dans la phase organique, selon la réaction : AH + HCO3- → A- + H2O + CO2
Les espèces ioniques A-, désormais solubles en phase aqueuse, sont éliminées avec celle-ci.
Q10 :
On agite l'ampoule à décanter afin de bien mélanger la deux phases non miscibles et de permettre les
transferts d'espèces d'une phase à l'autre.
La surpression observée est due au dégagement de CO2(g).
Q11 :
On constate un premier palier à 75-80°C. Il correspond au passage du cyclohexane.
Puis un second palier à 120-130°C qui correspond au passage de l'ester.
Q12 :
Le rendement est défini par rapport au réactif limitant : r = n(produit)/n(réactif limitant)
Le réactif limitant est l'alcool et n(réactif limitant) = 184 mmol.
On recueille entre 15 et 20 g d'ester.
Pour m(ester) = 20 g, n(ester) = 20/130,2 = 0,154 mol = 154 mmol.
r = n(ester) / n(ester)max = 154 / 184 = 0,84
Le rendement est de 84 %.
Les pertes ont lieu lors de la distillation (il reste de l'ester dans le ballon), on privilégie la pureté au
rendement.
Q13 :
Voir la table distribuée.
•On constate la disparition de la vibration d'élongation de la liaison O-H de l'acide acétique (à 3043
cm-1) et de l'alcool (à 3328 cm-1).
•On constate le déplacement de la vibration d'élongation de la liaison C=O. Dans l'acide, elle est à
1714 cm-1 (la table donne 1700-1725 cm-1) ; dans l'ester, elle passe à 1740 cm-1 (la table donne 1735-
1750 cm-1)
Cela montre que l'on a bien formé le produit désiré.
6 06 ,2 1
9 61 ,4 0
1 05 4 ,5 3
1 17 1 ,1 9
1 22 8 ,1 6
1 36 6 ,3 9
1 38 7 ,8 1
1 46 4 ,8 9
1 73 9 ,7 2
2 87 3 ,5 8
2 95 9 ,2 5
30
35
40
45
50
55
60
65
70
75
80
85
90
95
100
%T
1000 1500 2000 2500 3000 3500 4000
Nombre d'onde (cm-1)

09 et 16/01/2017 PC2016/2017 – Lycée La Martinière Monplaisir
ORGA TP n°10 – Correction – 4 / 4
Q14 :
H δ (ppm) Intégration Structure fine
Ha0,9 6 doublet (couplage avec 1 Hc)
Hb1,5 2 quadruplet (couplage avec 2 He et 1 Hc)
Hc1,7 1 multiplet (couplage avec 6 Ha et 2 Hb)
Hd2,1 3 singulet
He4,1 2 triplet (couplage avec 2 Hb)
L'intégration et la structure fine permettent d'attribuer tous les signaux.
On peut constater que le signal de He est très déblindé par la proximité de O.
O
O
Hd
Hd
Hd
He He
Hb Hb
Ha
Ha
Ha
Ha Ha
Ha
Hc
1
/
4
100%