Correction TP N°5

PC#Brizeux# TP#N°5#-#Correction# Altmayer-Henzien#2015-2016#
#
1/3$
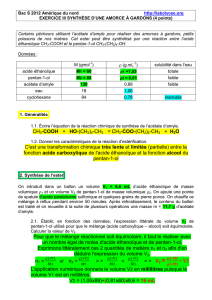
!"##$!%&"'(%)('*+(
#
,-./01023(1/0456-1073(8(
𝑉
!"#$$" =
𝑚!"#$$"
𝜌!"#$$"
=
𝑛!"#$$" 𝑀!"#$$"
𝑑!"#$$" 𝜌!"#
=
0,25×74,12
0,810×1
=22,9 𝑚𝐿 ≈22 𝑚𝐿 𝑖𝑛𝑡𝑟𝑜𝑑𝑢𝑖𝑡𝑠#
(
𝑉
!"#$% =
𝑚!"#$%
𝜌!"#$%
=
𝑛!"#$% 𝑀!"!"#
𝑑!"#$% 𝜌!"#
=
0,25×60,05
1,049×1
=14,3 𝑚𝐿 ≈15 𝑚𝐿 𝑖𝑛𝑡𝑟𝑜𝑑𝑢𝑖𝑡𝑠#
(
&9:(,-73015/3(
;:##
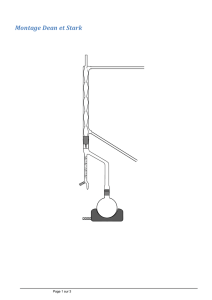
Montage#Dean-Stark#:#
Montage#de#distillation#fractionnée#:#
#
#
<:#Lors# de# la# réaction# d’estérification,# on# chauffe# le# milieu# réactionnel# pour# accélérer# la# réaction.# (La$
réaction$ étant$ athermique,$ cela$ n'influe$ pas$ sur$ la$ constante$ d'équilibre,$ et$ donc$ pas$ sur$ le$ rendement)#
L'APTS# est# un# catalyseur# acide.# Il# est# solide,# donc# n'apporte# pas# d'eau# supplémentaire# contrairement# à#
H2SO4,#et#est#soluble#en#milieu#organique.#
=:#Le#toluène# (ou# le# cyclohexane# pour# le# Groupe# 2)#permet# de#former#un# hétéroazéotrope#avec# l'eau,# et#
d'éliminer#l'eau#formée#au#fur#et#à#mesure#de#la#réaction.##
>1.?4.@@7(A1/.147(7.-B05C-D/7(
EF45-G7(;H(
>1.?4.@@7(A1/.147(7.-BIJIC5K7L./7(
EF45-G7(<H(
#
#

PC#Brizeux# TP#N°5#-#Correction# Altmayer-Henzien#2015-2016#
#
2/3$
Le#milieu#réactionnel#est#porté#à#84#°C,#température#
à# laquelle# on# observe# l'ébullition.#La# vapeur# est#
composée# d'un# mélange# toluène/eau# à# la#
composition# de# l'hétéroazéotrope# :#𝑥!"#
! = 0,4.# La#
vapeur# monte# dans# la# tubulure,# puis# est# liquéfiée#
par# le# réfrigérant.# Le# liquide# tombe# dans# le# tube#
décanteur# du# Dean-Stark.# L'eau# étant# plus# dense#
que# le# toluène,# elle# reste# piégée# au# fond# du# tube#
décanteur.#Le#trop-plein#de#toluène#retombe#dans#la#
tubulure#puis#dans#le#milieu#réactionnel.#
Le# milieu# réactionnel# est# porté# à# 69,5# °C,#
température# à# laquelle# on# observe# l'ébullition.#La#
vapeur# est# composée# d'un# mélange#
cyclohexane/eau# à# la# composition# de#
l'hétéroazéotrope# :#𝑥!"#
! = 0,3.# La# vapeur# monte#
dans#la#tubulure,#puis#est#liquéfiée#par#le#réfrigérant.#
Le# liquide# tombe# dans# le# tube# décanteur# du# Dean-
Stark.# L'eau# étant# plus# dense# que# le# cyclohexane,#
elle# reste# piégée# au# fond# du# tube# décanteur.# Le#
trop-plein#de#cyclohexane#retombe#dans#la#tubulure#
puis#dans#le#milieu#réactionnel.$
Remarque$:$Il$est$possible$d'utiliser$un$montage$Dean-Stark$avec$tout$solvant$formant$un$hétéroazéotrope$
avec$ l'eau,$ et$ dont$ la$ densité$ est$ plus$ faible$ que$ celle$ de$ l'eau$ (sinon$ c'est$ l'eau$ qui$ retomberait$ dans$ le$
milieu$réactionnel...).$Le$toluène$et$le$cyclohexane$conviennent,$mais$pas$le$dichlorométhane$par$exemple.$
#
On#sait#que#la#réaction#est#terminée#quand#on#n'observe#plus#d'eau#qui#s'ajoute#dans#le#tube#décanteur#du#
Dean-Stark.#Ici,#le#volume#d'eau#maximal#valait#:#
𝑉
!"#,!"# =
𝑚!"#,!"#
𝜌!"#
=
𝑛!"#,!"# 𝑀!"#
𝜌!"#
=
0,24×18
1
=4,3 𝑚𝐿#
#
M:#Le#lavage#de#la#phase#organique#avec#la#solution#saturée#de#carbonate#de#sodium#permet#d'éliminer#les#
traces#d'acide#restantes.#Le#dégagement#gazeux#observé#lors#du#lavage#avec#la#solution#de#NaHCO3#est#du#
CO2#gazeux,# formé# par# la# réaction# entre# les# acides# de# la# solution# et# NaHCO3.# La# formation# de# ce# gaz#
risquerait#d'entraîner#une#trop#forte#surpression#si#ce#lavage#était#effectué#dans#une#ampoule#à#décanter.#
On# ne# pouvait# pas# utiliser# une# solution# de# soude# au# lieu# de# la# solution# de# NaHCO3#car# la# soude# peut#
hydrolyser#l'ester#formé#en#acide#(saponification).##
+:#Le#lavage# de#la# phase# organique#avec#la# solution#saturée#de#chlorure#de#sodium#permet#d'éliminer#les#
dernières# traces# de# base,# sans# risquer# de# dissoudre# des# molécules# d'ester# dans# la# phase# aqueuse,# déjà#
chargée#en#NaCl.#Il#s'agit#d'un#relargage.#
N:#Masse#maximum#d'ester#attendue#:#
𝑚!"#!$,!!" =𝑛!"#!$,!"# 𝑀!"#!$ =0,24×116,16 =27,9 𝑔#
Rendement#:#
𝑅=
𝑚!"#!$,!"#
𝑚!"#!$,!"#
#
O:#>1301CC.015/(8#Un#palier#aurait#du#être#observé#vers#Teb(ester)#=#126#°C.#C'est#rarement#ce#qui#a#été#vu,#le#
Groupe#1#avait#un#mélange#toluène/ester#à#purifier#mais#les#températures#d'ébullition#étant#trop#proches,#
nous#n'avons#pas#observé#de#vrai#"palier"#de#distillation.#Pour#le#Groupe#2,#le#remplacement#du#toluène#par#
le#cyclohexane,#avec#une#Teb#plus#basse#que#celle#du#toluène#a#permis#d'améliorer#la#distillation#et#d'obtenir#
de#l'ester#pur#pour#beaucoup#de#binômes.#
&/61I7(67(42P4.I015/(8#En#cherchant#dans#le#Handbook,#on#pouvait#connaître#l'indice#de#réfraction#de#l'ester#:#
𝑛!"
!=1,3941.# Par# mesure# au# réfractomètre,# on# pouvait# considérer# l'ester# synthétisé# comme# pur# si# son#
indice#de#réfraction#est#égal#à#celui#tabulé#à#±0,001#près.#

PC#Brizeux# TP#N°5#-#Correction# Altmayer-Henzien#2015-2016#
#
3/3$
Q:#Mécanisme#:#
R Activation#électrophile#de#l’acide#carboxylique#par#le#catalyseur#acide#
#
R Addition# nucléophile# de# l’alcool# sur#l’acide# carboxylique# activé# et# formation# d’un# intermédiaire#
tétraédrique#
#
R Prototropie#pour#former#un#bon#groupe#partant#
#
R Elimination#d’une#molécule#d’eau#
#
R Régénération#du#catalyseur#
#
S:(TG7I047(&#(8(
vers#2900#cm−1#:#bande#de#vibration#d'élongation#de#la#liaison#C−H#alcane#
vers#1740#cm−1#:#bande#de#vibration#d'élongation#de#la#liaison#C=O#ester#
#
TG7I047(#U'(;V(8(
δ#(ppm)#
multiplicité#
intégration#
attribution#
4,0#
triplet#(2#voisins)#
2#H#
CH2−O#(assez#déblindé)#
2,1#
singulet#(pas#de#voisin)#
3#H#
H3C−C=O#(un#peu#déblindé)#
1,5#
multiplet#
4#H#
2#*#(CH2−C)#
1,0#
triplet#(2#voisins)#
3#H#
H3C−C#
#
ROH
O
ROH
OH
ROH
OH
H
ROH
OH
+R' OH ROH
OH
OHR'
AN
ROH
OH
OHR'
R O
OH
O
R'
H
H
R O
OH
O
R'
H
H
OH
ROR'
+H2O
E
O
H
ROR'
O
ROR'
+H
O
O
H
H
H
HHHH
H
H
H
HH
4,0 ppm
2,1 ppm 1,0 ppm
1,5 ppm
1
/
3
100%