NOTIFICATION DE PROJET DE DISSÉMINATION DE PLANTES

DOSSIER TECHNIQUE
NOTIFICATION DE PROJET DE DISSÉMINATION DE
PLANTES SUPÉRIEURES GÉNÉTIQUEMENT MODIFIÉES
(ANGIOSPERMAE ET GYMNOSPERMAE)

__________________________________________________________
__ p 2 / 25
PREAMBULE
La mise au champ de plantes génétiquement modifiées est soumise à une réglementation européenne
décrite dans la directive européenne 90/220 transposée dans la loi française du 13 juillet 1992. Cette
directive 90/220 vient par ailleurs d’être modifiée et remplacée par la directive 2001/18 du 17 avril
2001. Cette nouvelle directive conforte le principe d’une progression par étape qui permet d’adapter
progressivement l’ampleur de la dissémination en fonction des connaissances acquises sur ces plantes
et notamment sur leurs effets sur la santé humaine et l’environnement. Ainsi, en fonction de l’état
d’avancement des dossiers au sein du processus réglementaire (de la recherche amont vers le
développement et la mise sur le marché) le niveau des informations acquises et disponibles sera
différent et beaucoup plus élevé pour un événement de transformation en cours d’évaluation dans le
cadre d’une autorisation de mise sur le marché (utilisation à grande échelle) que pour un essai de type
recherche (culture très localisée pendant une courte période).
Les plantes génétiquement modifiées décrites dans ce dossier contiennent un événement de
transformation , Bt11, qui a déjà fait l’objet d’autorisation de mise sur le marché pour différents usages
dans de nombreux pays . En Europe, cet événement a reçu une autorisation de mise au marché (au
titre de la Partie C de la directive 90/220) pour tout usage à l’exception de la culture (décision de la
Commission 98/292/EC). Il a fait l’objet d’une notification dans le cadre du règlement 258/97 relatif
aux Nouveaux Aliments et aux Nouveaux Ingrédients en janvier 1998. Un dossier de mise au marché
pour la culture soumis par la France à la Commission européenne est actuellement en cours
d'instruction. Ce dossier a reçu un avis favorable de la CGB le 3 décembre 1998 et du Comité
Scientifique des Plantes de la Commission européenne le 30 novembre 2000.
Ce dossier concerne une demande d’autorisation pour réaliser des essais obligatoires dans le cadre de
la réglementation sur les semences et les plants . En effet il s’agit de l’étude des variétés nouvelles dans
le cadre des épreuves officielles d'inscription au catalogue officiel et de protection des obtentions
végétales telle que définit par la directive européenne 70/457 modifiée par la directive 98/95. Ces
études qui s’appliquent à toute nouvelle variété, génétiquement modifiée ou non, comprennent deux
volets : une épreuve de distinction, homogénéité et stabilité (DHS) destinée à vérifier la nouveauté de la
variété et à établir sa fiche descriptive ; une épreuve de valeur agronomique et technologique (VAT)
destinée à évaluer ses qualités culturales et technologique. Seul un succès à ces épreuves permet
d’autoriser la vente de la nouvelle variété : cette autorisation est officialisé par un décret ministériel.

__________________________________________________________
__ p 3 / 25
SOMMAIRE
INTRODUCTION
A. INFORMATION GÉNÉRALE
B. CARACTÉRISTIQUE BIOLOGIQUE DE L’ESPÈCE VÉGÉTALE RÉCEPTRICE
C. INFORMATION SUR LA MODIFICATION GÉNÉTIQUE
D. INFORMATION CONCERNANT LA PLANTE SUPÉRIEURE GÉNÉTIQUEMENT
MODIFIÉE
E. INFORMATION CONCERNANT LES SITES DE DISSEMINATION
F. INFORMATION CONCERNANT LA DISSÉMINATION
G. INFORMATION SUR LES PLANS DE SURVEILLANCE, DE CONTRÔLE, ET DE
TRAITEMENT DU SITE ET DES DÉCHETS APRES DISSÉMINATION
H. INFORMATIONS SUR LES ÉVENTUELLES INCIDENCES DE LA
DISSÉMINATION DES PLANTES GÉNÉTIQUEMENT MODIFIÉES SUR
L’ENVIRONNEMENT.

__________________________________________________________
__ p 4 / 25
INTRODUCTION
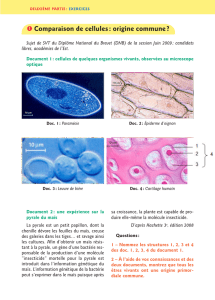
Le maïs Bt 11 développé par la société Syngenta peut s’auto-protéger contre deux insectes
dévastateurs de la plante : la pyrale du maïs (Ostrinia nubilalis) et la sésamie (Sesamia sp.)
Les deux insectes appartiennent à la famille des Lépidoptères.
La pyrale est une espèce très répandue qui cause de grands ravages dans les cultures . On
observe une seule génération par an dans le Nord et deux générations dans le Midi
méditerranéen.
En été les papillons déposent leur ponte à la face inférieure des feuilles de maïs situées au-dessus
ou au dessous de l’épi. Après une incubation dont la durée varie de 1 à 4 semaines en fonction
de la température, les larves de pyrale apparaissent et se « baladent » sur les feuilles et la tige
(stade baladeur) pour pénétrer dans la tige par la partie sommitale de la plante. Elles pénètrent
ainsi dans la tige et y exercent leur activité de forage. Elles creusent des galeries à l’intérieur de
la tige du maïs où elles ne peuvent être traitées par des moyens biologiques et chimiques
classiques. Elles mangent la tige et détruisent les vaisseaux responsables du transport des
éléments nutritifs de la plante. A l’arrivée des premiers froids les larves redescendent à la base de
la tige pour hiberner. Avec l’arrivée des jours longs et des températures plus élevées, les larves
hibernantes se transforment en nymphes pendant les mois de mai-juin. Les papillons de première
génération émergeront en juin-juillet.
Larve de pyrale : Nymphes :
Papillon :

__________________________________________________________
__ p 5 / 25
Différents dégâts sont provoqués par ces insectes sur les cultures de maïs :
- La casse des panicules mâles au niveau de la dernière feuille ce qui limite l’émission de pollen et
pénalise la formation de grains.
- Le dessèchement de la plante et la fragilisation des tiges qui, minées de galeries, sont
susceptibles de se casser.
- La recrudescence des pathogènes dont les galeries servent de porte d’entré. La perforation des
épis favorise ainsi le développement de champignons pathogènes, les Fusarium, qui produisent
des mycotoxines susceptibles d’être dangereuses pour l’homme et les animaux.
Ces dommages sont d’autant plus rédhibitoires qu’ils remettent en cause les critères de réussite
d’une culture de maïs : la régularité des résultats, la tenue de tige ou résistance à la verse, le
rendement.
Exemple de dégâts au niveau du panicule mâle :
Les pyrales peuvent donc avoir un effet dévastateur sur la production de maïs. Dans certaines
régions, les destructions peuvent représenter jusqu’à 30 % de la récolte. Au plan mondial, 7 %
environ de la récolte annuelle est endommagée par cet insecte. Ce qui équivaut à l’alimentation
annuelle, en calories, de 60 millions de personnes (soit, à peu près, la population française ou
britannique). L’infestation de la pyrale coûte tous les ans 1 milliard de $US aux Etats-Unis et
50 millions d'euros en France, par suite des pertes de rendement et du prix des traitements. Aux
Etats-Unis, entre 20 et 30 millions de dollars sont dépensés chaque année en achat de pesticides
pour lutter contre ce fléau.
Comparable dans son comportement à la pyrale, la sésamie est aussi un ravageur qui nuit
fortement à la culture du maïs. C’est un insecte sub-tropical que l’on trouve principalement dans
le sud de la France et en Espagne, et qui est très nuisible pour les cultures.
Différents moyens de lutte contre ces insectes ravageurs sont applicables :
La lutte chimique : cette méthode est la plus répandue. Elle consiste en l'application d'un
insecticide que l'on positionne de manière précise pour toucher la larve au stade baladeur.
L’agriculteur dispose donc de quelques jours pour décider du traitement et l’appliquer en
espérant que les conditions climatiques ne viendront en altérer l’efficacité.. Du fait de la taille des
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
1
/
25
100%