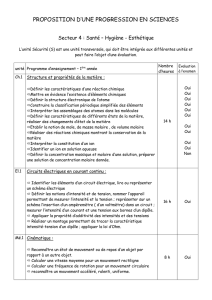
Etats de la matière

BIOPHYSIQUE : COURS / ETATS DE LA MATIERE
Connaissances essentielles du cours
Structure de la matière
Quarks (U et D)
Nucléons : neutron (2D+U), proton ( 2U+D)
Noyau : A nucléons : A nombre de masse
- Z protons ( Z numéro atomique)
- N = (A – Z ) neutrons
Atome . ( Voir chimie)
Assemblage dans la matière
Liaison atomique ou de covalence ( forte, dirigée ) : molécules
Liaison ionique : forte, non dirigée, en 1/r2
Liaison semi-polaire ou de coordinence
Liaisons intermoléculaires : forces de Van der Waals
- en 1/r7
- dipôle électrique : moment dipolaire :
dqM r
r×=
; ( M = q . d en C.m)
Forces de Keesom :
- interaction entre molécules possédant un moment dipolaire permanent : interaction dipôle permanent-dipôle
permanent
- cas particulier des liaisons hydrogène
Forces de Debye :
interaction entre molécule polaire et molécule non polaire : interaction dipôle permanent-dipôle induit
Forces de London :
interaction entre molécule non polaires : interaction dipôle instantané-dipôle instantané
Différents états de la matière
Etat gazeux
Gaz parfait : molécules considérées comme ponctuelles, pas d’interaction entre les molécules
Equation d’état des gaz parfaits
p.V = n.R .T
p en Pa, V en m3, n en mol , T en K : R = 8,32 J.mol-1K-1
P en atm, V en L, n en mol , T en K : R = 0,082 L.atm.mol-1K-1
Mélange de gaz parfaits n =∑i
n pression partielle pi = ni RT / V p =
∑
i
p
( loi de Dalton )
Gaz réel
Equation de Van der Waals
( p + a / V2 ) . ( V – b ) = n . R .T
Etat solide
Etats cristallin, polymère et amorphe
Etat liquide
Equilibre liquide- vapeur
Loi de Henry
Soit un mélange liquide de constituants i en équilibre avec sa phase gazeuse
ci = a . pi
ci : concentration du constituant i dans le mélange liquide
pi : pression partielle du constituant i dans la phase gazeuse
a : coefficient de Henry : a = 0,03 mM.L-1. (mm . Hg)-1
cristaux liquides
état vitreux

Aspect quantitatif
Masse d’un nucléon ( proton , neutron ) ≈ 1,67. (5/3) 10-27 kg ≈ 1 u.m.a.
Masse de l’atome ≈ masse du noyau ≈ A u.m.a.
1 mole = NA entités ; NA nombre d’Avogadro 6,02.1023 mol-1
Masse molaire atomique = atome-gramme = masse 1 mol. d’atomes ≈ A g
Masse molaire élément = moyenne masses molaires des isotopes constituant l’élément
Masse molaire moléculaire = molécule-gramme
Masse molaire ionique = ion-gramme
NB : Il se peut qu’il existe des problèmes lors de la création des formats .pdf avec certains caractères spéciaux. Nous avons
remarqué que les flèches situées au dessus des lettres représentant les dipôles électriques se transformaient en « r ». Nous
essayons de trouver une solution pour les prochains cours. Veuillez nous excuser pour ces petits problèmes.
1
/
2
100%