Définition - Canalblog

BIOCHIMIE
BIOCHIMIE

Table of Contents
111Constituants chimiques de la matière vivante..............................................................................4
1.1Composition élémentaire du corps humain................................................................................4
1.1.1Élément Majeurs.................................................................................................................4
1.1.2Oligoéléments.....................................................................................................................4
1.2 Liaison chimique........................................................................................................................4
1.2.1 Liaison a forte énergie de liaison.......................................................................................4
1.2.1.a Liaison covalente........................................................................................................4
1.2.1.b Liaison ionique...........................................................................................................4
1.2.2 Liaison de faible énergie ...................................................................................................5
1.2.2.a Liaison hydrogène......................................................................................................5
1.2.2.b Force de Van der waals...............................................................................................5
1.2.2.c Interaction hydrophobe ..............................................................................................5
1.3 Eau.............................................................................................................................................5
1.3.1 Répartition..........................................................................................................................5
1.3.1.a Selon les tissue............................................................................................................5
1.3.1.b Selon les secteur hydrique..........................................................................................5
1.3.2 Caractéristique physico-chimique de l'eau ........................................................................6
1.3.2.a Molécule polaire.........................................................................................................6
1.3.2.b Association de molécule d'eau par liaison hydrogène................................................6
1.3.2.c Comportement des molécule en présence d'eau.........................................................6
1.4 Les constituants minéraux.........................................................................................................7
1.4.1 Propriété.............................................................................................................................7
1.4.1.a Concentration en équivalent ( Eq ).............................................................................7
1.4.1.b Force ionique d'une solution.......................................................................................7
1.4.1.c Osmolarité et pression osmotique d'une solution .....................................................7
1.4.2 Répartition des principaux constituants minéraux.............................................................8
1.4.2.a Constituants minéraux a l'état solide..........................................................................8
1.4.2.b Constituants minéraux en solution.............................................................................8
1.5 Constituants organiques.............................................................................................................8
222 Protides.....................................................................................................................................9
Introduction...............................................................................................9
2.1 Les acides aminés......................................................................................................................9
2.1.1 Structures et classification des acides aminés ...................................................................9
2.1.1.aDéfinition et formule générale.....................................................................................9
2.1.1.b Structure des acides aminés protéinogène................................................................10
2.1.1.c Classification des acides aminés ..............................................................................10
2.1.2 Propriété des acides aminés.............................................................................................10
2.1.2.a solubilité...................................................................................................................10
2.1.2.b Absorption de la lumière .........................................................................................11
2.1.2.c ionisation des acides aminés.....................................................................................11
2.1.2.d réaction a la ninhydrine............................................................................................13
2.2Peptide......................................................................................................................................13
2.2.1La liaison peptidique.........................................................................................................13
2.2.1.aStucture de la liaison peptidique................................................................................13
2.2.1.b Propriété de la liaison peptidique ...........................................................................14
2.2.1.cRéaction du biuret......................................................................................................15
2.2.2Nomenclature des peptide nombre d'aa............................................................................15
2.2.2.aNombre d'aa...............................................................................................................15
2.2.2.b Nature des acides aminés.........................................................................................16
2.2.2.c sequence peptidique..................................................................................................16

2.2.3 Étude de quelque peptide d'intérêts .................................................................................16
2.2.3.a Insuline.....................................................................................................................16
2.2.3.b Glutathion ................................................................................................................16
2.2.3.c structures...................................................................................................................16
2.2.3.d propriété....................................................................................................................16
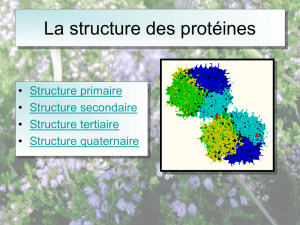
2.3Protéines....................................................................................................................................18
2.3.1Les niveau de structures des protéines..............................................................................18
2.3.1.aStructures primaire....................................................................................................18
2.3.1.bStructures secondaire ................................................................................................18
2.3.1.cstructures tertiaires.....................................................................................................18

1
1Constituants Chimiques De La Matière Vivante
Constituants Chimiques De La Matière Vivante
1.1
1.1 Composition Élémentaire Du Corps Humain
Composition Élémentaire Du Corps Humain
1.1.1
1.1.1 Élément Majeurs
Élément Majeurs
Élément majeurs car + de 99,9% du totale 4 élément C,H,O,N représente +de 96,5% du
totale.
➢Molécules Organique ( Glucide, lipide, protide, acide nucléique), P, S son présent dans
les molécule organique et minéral ( PO4, SO4 ) Ca, K, Cl, Na, Mg6minéral.
1.1.2
1.1.2 Oligoéléments
Oligoéléments
Présents en très petite quantité il s'agir surtout de métaux -de 0,1%
Interviennent dans l'activité des molécules organique ( fer dans l'hémoglobine)
Cofacteur de certaine Enzymes. Toxique a forte concentration.
1.2
1.2 Liaison Chimique
Liaison Chimique
La force d'une liaison est chiffré par l'énergie de liaison ( énergie nécessaire pour rompre
une liaison exprimé en KJ.mol-1)
1.2.1
1.2.1 Liaison A Forte Énergie De Liaison
Liaison A Forte Énergie De Liaison
1.2.1.a
1.2.1.a Liaison Covalente
Liaison Covalente
Ces liaison résulte de la mise en commun d'électron entre deux atome.
➢Énergie de liaison très élevé (>200 KJ/mol)liaison de forte énergie
➢Stable dans les condition cellulaire ne sont rompu que dans des réaction chimique
catalysé par des enzyme (ex: liaison simple C-C ou double C=C)
➢Polarisation des liaison classement des atome par ordre négativité croissante
O>N>S>C>H>P
➢Dans une liaison covalente les électron sont attiré par l'atome le + électronegatif. La
liaison est dite polarisé.
O O
+
-
Un dipôle est caractérisée par son moment dipolaire représenté par un vecteur
ORIENTE DU- VERS LE +. Les liaison C-O sont très polarisée.
1.2.1.b
1.2.1.b Liaison Ionique
Liaison Ionique
Elle résulte de l'attraction électrostatique entre les ion de charge opposée
Énergie de liaison élevé et peut etre formé entre deux ions minéraux organiques.
Ex: COO- …......NH3+

1.2.2
1.2.2 Liaison De Faible Énergie
Liaison De Faible Énergie
1.2.2.a
1.2.2.a Liaison Hydrogène
Liaison Hydrogène
Liaison qui s'établit entre:
➢Un atome d'hydrogène lié par covalence a un atome électronégatif.
➢Un autre atome électronégatif.
Dix foi moins forte que les liaison covalente.
Ex: >N-H / / / / / / / / / / / / / / / O=C <
1.2.2.b
1.2.2.b Force De Van Der Waals
Force De Van Der Waals
Résulte de l'attraction électrostatique entre des molécule qui possède un moment
dipolaire. Cent fois moins forte que les liaison covalentes.
1.2.2.c
1.2.2.c Interaction Hydrophobe
Interaction Hydrophobe
En milieu aqueux les groupement hydrophobe ce regroupe pour présenter une surface
minimale au molécule d'eau. Cent fois moins forte que les liaison covalentes.
Ces liaison faible permette la cohésion des structures membranaire.
L'ensemble des liaison faible participe a la formation de protéines, participe aux
interaction entre structure complémentaire. Complexe enzyme substrat. Réaction
immunitaire ( complexe antigène anticorps ).
1.3
1.3 Eau
Eau
En moyenne 60% d'eau par rapport au poids corporel.
1.3.1
1.3.1 Répartition
Répartition
1.3.1.a
1.3.1.a Selon Les Tissue
Selon Les Tissue
Répartition inégale selon les tissue. Diminution avec l'age. Faible si forte adiposité.
Plus élevé chez l'homme que chez la femme.
1.3.1.b
1.3.1.b Selon Les Secteur Hydrique
Selon Les Secteur Hydrique
% par rapport au poids corporel
5%
15%
40%
Secteur plasmatique
3,5 L
Paroi de capilaire
vaisseau sanguin
Secteur interstitiel
10,5 L
Membrane
plasmique
Secteur
extracellulaire
14 L
Secteur
Intracellulaire
28 L
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
1
/
18
100%