Passage d`un groupe caractéristique à un autre

Passage d'un groupe caractéristique à un autre
Exercice 1
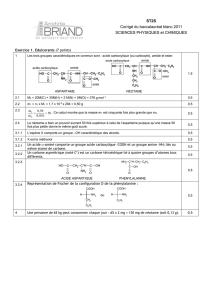
1. La formule générale d'un dérivé halogéné peut être écrite: R—X où X est l'atome d'halogène (F,
Cl, Br, I).
a. Il faut utiliser l'ammoniac NH3en excès.
b. Il faut utiliser les ions hydroxyde HO-(solution d'hydroxyde de sodium Na++HO-par exemple).
2. Les équations des réactions correspondantes sont:
a. R—X + 2NH3R—NH2+NH4++ X-
b. R—X + HO-R—OH + X-
Exercice 2
1. La formule semi-développée de la propylamine est: CH3—CH2—CH2—NH2.Il faut utiliser un
alcool qui possède la même chaîne carbonée. On utilisera le propan-1-ol de formule semi-
développée: CH3—CH2—CH2—OH.
2. Il semble que pour passer de l'alcool à l'amine il suffise de substituer (remplacer) le groupe
hydroxyle —OH de l'alcool par le groupe nitro —NH2de l'amine. En fait cette substitution n'est
pas possible directement. Il faut passer par un dérivé halogéné de même chaîne carbonée, par
exemple le dérivé chloré, suivant le schéma:
CH3—CH2—CH2—OH CH3—CH2—CH2—Cl CH3—CH2—CH2—NH2
3. L'équation de la transformation correspondant à la première étape est:
CH3—CH2—CH2—OH + H++Cl-CH3—CH2—CH2—Cl + H2O
L'équation de la transformation correspondant à la deuxième étape est:
CH3—CH2—CH2—Cl +2NH3CH3—CH2—CH2—NH2+NH4++Cl-
Exercice 3
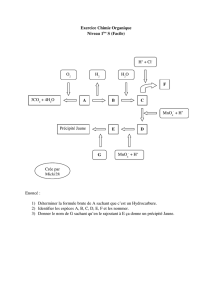
1. La suite de transformations à mettre en oeuvre peut être schématisée de la façon suivante:
2. L'équation relative à la première étape est:
L'équation de la deuxième étape est:

Exercice 4
1. Il s'agit du passage d'un alcool secondaire à un dérivé iodé. C'est une substitution du groupe
hydroxyle par un atome d'iode. L'équation s'écrit:
2. La quantité de matière d'alcool initiale est:
n(al)0= m / M(al) = 26,0 / 74,0 = 0,351 mol
Dans le tableau d'avancement nous ne ferons pas figurer l'eau. On a alors:
Équation de la réaction C4H10O + H++ I-C4H9I + H2O
Etat initial (mol) n(al)0=0,351 n(H+)0=C V n(RI)0=0,00
Etat à la date t (mol)
l'avancement est x n(al)=n(al)0-x n(H+)=C V-x n(RI)=x
Etat final (mol)
l'avancement est xmax n(al)f=n(al)0-x
max
n(H+)f= C V-xmax n(RI)f=xmax
L'alcool est le réactif limitant alors n(al)f=0 alors
n(al)0-xmax = 0 => xmax = n(al)0
alors n(H+)f> 0 => CV- n(al)0> 0 =>
lavaleur minimale cherchée est donc:
Vmin = n(al)0/ C = 0,351 / 7,5 = 4,7.10-2 L =47 mL
3.D'après le tableau d'avancement, la quantité de matière de dérivé iodé (RI) que l'on pourrait
obtenir est n(RI)f=0,351mol. La quantité de matière réellement obtenue est:
n(RI) = m' / M(RI) = 40,0 / 183,9 = 0,218 mol
le rendement de la synthèse est donc: =n(RI) / n(RI) 0 = 0,218 / 0,315 =0,621
Exercice 5
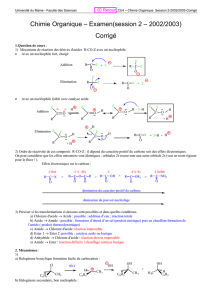
1. La molécule présente le groupe amino —NH2.L'aniline appartient à la famille des amines.
2. La réaction d'hémisynhtèse du nitrobenzène s'écrit:
C6H6+HNO3C6H5—NO2+ H2O

Il s'agit d'une substitution d'un atome d'hydrogène du benzène par un groupe nitro —NO2fourni
par l'acide nitrique.
3. Les demi-équations redox et l'équation de la réaction s'écrivent:
C6H5—NO2+7H++6e-=C6H5—NH3++2H2O
Fe = Fe2+ + 2e-x 3
C6H5—NO2+7H++3Fe C6H5—NH3++3Fe2+ + 2H2O
4. La quantité de matière de nitrobenzène initiale est:
n(nitro)0= m / M(nitro) = 15,0 / 123,0 =0,122 mol
etla quantité de matière de fer initiale est:
n(Fe)0=m2/M(Fe) = 30,0 / 55,8 = 0,538 mol
D'après l'équation de la réaction et les nombres stoéchiométriques, la quantité de matière de fer
initiale permet de réduire une quantité de matière de nitrobenzène n(nitro) telle que:
n(nitro) = n(Fe)0/ 3 = 0,538 / 3 = 0,179 mol
ornous ne disposons que de n(nitro)0=0,122mol. Le nitrobenzène est en défaut, c'est le réactif
limitant.
5. Les réactions sont: H3O++HO-2H2O
C6H5—NH3++HO-C6H5—NH2+ H2O
6. L'équation de la réaction de préparation de l'aniline résulte de la somme des deux
transformations précédentes. On a donc en écrivant H3O+àla place de H+et en simplifiant ce
qui est simplifiable (en particulier H3O++HO-2H2O) on a:
C6H5—NO2+7H3O++3Fe C6H5—NH3++3Fe2+ + 9H2O
C6H5—NH3++HO-C6H5—NH2+ H2O
C6H5—NO2+6H3O+
+3Fe
3Fe2+ + 8H2O + C6H5—NH2
D'après l'équation précédente et les nombres stoéchiométriques, la quantité de matière d'aniline
maximale que l'on pourrait obtenir est
n(an) = n(nitro)0=> n(an) = 0,122 mol
La quantité de matière d'aniline réellement obtenue est
n = m3/M(an) = 7,60 / 93,0 =8,17.10-2 mol
le rendement de cette hémisynthèse est donc = n / n(an) = 8,17.10-2 / 0,122 =0,670
1
/
3
100%