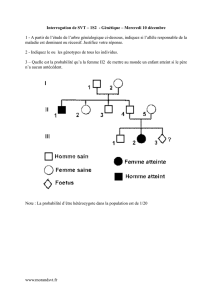
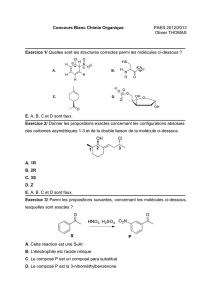
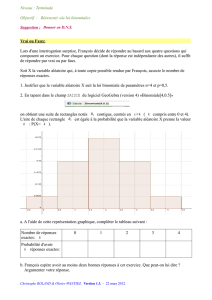
Question 1 - Tutorat Associatif Marseillais

Question 1:
Concernant les états de la matière, indiquez la ou les réponses exactes:
A. L'état d'une matière se définit par son état microscopique
B. Les liaisons ioniques sont des liaisons faibles intermoléculaires
C. Ce sont les liaisons métalliques qui permettent d'appliquer la conductivité
D. La liaison de Van Der Waals est d'origine électrostatique
E. En sur-saturation et a pression constante, la tension du gaz dissout est supérieure à la
pression du gaz libre
Question 2:
Concernant , indiquez la ou les réponses exactes:
A. Les liquides sont ordonnés
B. les solides sont ordonnés
C. les liquides sont décondensés
D. les liquides sont en mouvement et désordonnés
E. les solides sont ordonnés et décondensés
Question 3:
Concernant les potentiels chimiques, indiquez la ou les réponses exactes:
A. Le premier principe de thermodynamique énonce qu'il y a conservation de l'énergie totale
du système : Esystème=U, avec U : variable d'état représentant l'énergie interne.
B. L'entropie (S) est la portion d'énergie non disponible pour le travail.
C. D'après le deuxième principe de thermodynamique, au cours d'une transformation
spontanée et monotherme, la variation d'entropie du système est supérieure au terme dû à
l'échange de chaleur (inégalité de Clausius).
D. L'enthalpie (H) est la chaleur échangée par le système qui se transforme à température
constante.
E. Lorsque la variation d'enthalpie libre (ΔG) est supérieure à 0, le système est endergonique
et la transformation est spontanée.
Question 4:
Concernant les potentiels chimiques, indiquez la ou les réponses exactes:
A. Pour les gaz parfaits purs, la variation d'enthalpie libre en fonction de la pression doit tenir
compte des interactions intermoléculaires.
B. La fugacité (f) est une notion propre aux gaz réels purs, qui représente la pression fictive
sous laquelle devrait se trouver le gaz s'il était parfait pour posséder l'enthalpie libre
molaire à température constante (Gm(T)).
C. Un mélange désigne une phase liquide ou solide contenant plus d'une substance (lorsque
les substances sont toutes considérées de la même manière).
D. Dans un mélange de gaz parfaits, chaque gaz (B) présent a une pression partielle (PB)
proportionnelle à la fraction molaire de ce gaz dans le mélange gazeux (yB)
E. Si on considère un solide dissout dans un liquide pour former une solution diluée, la
fraction molaire xsoluté négligeable devant xsolvant, ce qui implique que le potentiel chimique
du solide à température constante est égal à l'enthalpie libre molaire de référence du solide
à température constante.
Question 5:
Concernant les changements d'états et pression de vapeur, indiquez la ou les réponses
exactes:
A. Il existe 2 types de transitions de phases: de premier ordre impliquant une chaleur latente
et de second d'ordre sans chaleur latente.
B. La solidification des corps purs se fait uniquement à température constante.
C. L'enthalpie molaire de vaporisation est une énergie qui sert à vaincre les forces de

cohésions entre les molécules (intermoléculaires) pour les séparer.
D. Dans une enceinte ouverte et à température constante, plus la Pression de vapeur
saturante est forte, plus le liquide est dit volatile.
E. La variance est calculée par la règle des phases établie par Gibbs. Cette règle des phases
ne peut être appliquée uniquement s'il n'y a pas de réaction chimique.
Question 6:
Concernant les propriétés colligatives des solutions, indiquez la ou les réponses exactes:
A. Les propriétés colligatives sont des grandeurs thermodynamiques de solutions ou de
suspensions qui dépendent du nombre de molécules présentes et non de la nature
chimique des molécules présentes.
B. La matière est continuellement soumise à deux mouvements opposés : le rassemblement
(liaisons intramoléculaires) et la dispersion (phénomène d’agitation thermique).
C. La solubilité du soluté dépend de la nature du solide, de celle du liquide et de la pression
(généralement la solubilité augmente si la pression augmente).
D. La fraction molaire permet de connaitre les proportions relatives de chaque corps pur
constituant une solution. C’est le rapport du nombres de moles du soluté sur le total du
nombre de moles dans la solution.
E. La détermination du nombre d’entités cinétiques dépend du caractère neutre ou
électrolytique du solvant.
Question 7:
Concernant les propriétés colligatives des solutions, indiquez la ou les réponses exactes:
A. Dans la théorie D’Arrhenius (électrolyte fort), il faut connaitre le coefficient de dissociation α
pour déterminer le nombre de molécules présentes dans la solution.
B. L’osmolarité est reliée à la molarité par i, le facteur de Van’t Hoff . L'osmolarité est inférieur
ou égale à la molarité.
C. D'après François-Marie Raoult: La pression de vapeur d’une solution idéale est
dépendante de la pression de vapeur saturante de chaque constituants, et de leurs
fractions molaires respectives.
D. Une solution réelle est une solution qui a une déviation positive ou négative par rapport à la
loi de Raoult et où les interactions soluté/solvant sont importantes.
E. Lors de la mise en solution d’un soluté non volatil, la solution a, entre autre, par rapport au
solvant pur une pression osmotique qui entraine le solvant du compartiment le moins
concentré vers le compartiment le plus concentré.
Question 8:
Concernant la spectrométrie optique, indiquez la ou les réponses exactes:
A. L'équation de Planck unifie la double nature ondulatoire (fréquence et longueur d'onde) et
corpusculaire (énergie) des rayonnements.
B. La dissociation (ou photolyse) est la rupture de la liaison interatomique de la molécule
donnant naissance à des radicaux libres.
C. D'après la loi de Stefan Boltzman, quand la température augmente, l'énergie totale
rayonnée augmente.
D. La phophorescence est un processus de fluorescence retardée par le passage par un état
excité triplet (ou état métastable) se situant à un niveau d'énergie infèrieur à celui du
premier état excité singulet.
E. Le spectre d'émission de l'hydrogène par électroluminescence est constitué d'une série de
raies dans le visible : série de Lyman, une série de raies dans l'ultraviolet : série de Balmer
et de trois séries de raies dans l'infrarouge dont la série de Paschen (infrarouge proche).
Question 9:
Concernant la spectrométrie optique , indiquez la ou les réponses exactes:

A. Un émetteur laser doit comprendre 3 parties : un milieu actif, un mécanisme de pompage
(permettant l'inversion de population) et un résonateur optique (qui favorise la réaction en
chaine suivant l'émission stimulée).
B. La cohérence spatiale est liée à la largeur de la bande spectrale émise alors que la
cohérence temporelle est liée à l'homogénéité du milieu émetteur.
C. L'irradiance est l'énergie du rayonnement délivré par unité de surface en J.m-2.
D. Les lasers à gaz ont un pompage électrique ou optique, une très bonne cohérence et
émettent dans l'infrarouge, l'ultraviolet et le visible.
E. La volatilisation est un des effets photothermiques des lasers, caractérisé par une perte de
substance immédiate et apparition d'une zone de nécrose de coagulation responsable d'un
effet homéostatique. Elle est utilisée notamment pour l'incision sans saignement.
Question 10:
Concernant la spectrométrie optique, indiquez la ou les réponses exactes:
A. La loi de Beer-Lambert est valide à trois conditions : lumière monochromatique, liquide
transparent et concentration élevée (kg.L-1).
B. La transmission est l'inverse de l'opacité.
C. L'oxymétrie de pouls est une mesure non invasive de la saturation artérielle en oxygène.
D. La photopléthysmographie est la mesure des variations de volume d'un organe ou d'une
partie du corps en fonction du volume sanguin qui l'irrigue.
E. Les phénomènes d'interférence faussent les valeurs de SpO2, par exemple : l'utilisation de
colorants comme traitements (vert d'indocyanine, bleu de méthylène) entraine une sous
estimation de la valeur de SpO2.
Question 11:
Concernant l'optique, indiquez la ou les réponses exactes:
A. On appelle dioptre toute surface séparant 2 milieux homogènes et transparents.
B. Selon la relation de Descartes, si n1 est plus grand que n2, alors i2 (angle de réfraction)
sera plus loin de l'axe optique que i1 (angle d'incidence).
C. Un dioptre est dit stigmatique s'il donne d'un objet ponctuel une image ponctuelle.
D. Pour appliquer la propriété de stigmatisme à une dioptre sphérique on établit des
conditions constituant l'approximation de Gauss : on doit avoir une faible incidence et le
pinceaux lumineux doit être proche de l'axe optique du dioptre.
E. Pour les dioptres convergents, D (la puissance) est supérieure à 0, la distance focale
image est inférieure à 0 et la distance focale objet est supérieure à zéro.
Question 12:
Concernant l'optique, indiquez la ou les réponses exactes:
A. 3 rayons lumineux permettent d'obtenir l'image d'un objet quelconque après la traversée
d'un dioptre sphérique, par exemple on peut utiliser le rayon parallèle à l'axe principal qui
passe par le point focal image après traversée du dioptre (dans le cas d'un dioptre
convergent).
B. L'oeil est constitué de 4 dioptres dont le dioptre cristallinien antérieur qui est le plus
puissant de l'oeil.
C. Le punctum remotum est la position du point objet dont le point conjugué image est sur la
rétine avec une puissance du dioptre à son minimum (D0).
D. L'oeil myope n'a pas de plage de vision nette sans correction.
E. Pour la correction de la myopie on va utiliser une lentille divergente. Mais dans le cas de
verres de lunettes on doit en plus faire une surcorrection.

Question 13:
Un sujet présente un degré d'amétropie de +3D. Son punctum proximum se situe à 20cm
en arrière de son œil.
indiquez la ou les réponses exactes:
A. Le sujet est myope.
B. La proximité du proximum est de -5D.
C. L'amplitude d'accomodation A est de -2D.
D. Le degré d'amétropie correspond à la proximité du remotum.
E. Le sujet peut subir une correction de son amétropie grâce à la chirurgie réfractive.
Question 14:
Concernant la régulation des milieux intérieurs, indiquez la ou les réponses exactes:
A. Les vaisseaux sont perméables à l'eau, aux petits ions mais imperméables aux grosses
molécules.
B. L'eau totale représente 60% du poids corporel et est répartie en liquide extra-cellulaire pour
2/3 et liquide intra-cellulaire pour 1/3.
C. Le pourcentage d'eau varie avec : l'indice de masse corporelle (IMC) et l'âge. VRAI
D. Selon la loi de Starling : si la pression de filtration (PF) est inférieure à 0 il y a ultrafiltration.
E. La balance hydrique entrée/sortie doit être égale. Dans le cas inverse on a des
gonflements ou des pertes en eau.
Question 15:
Concernant la régulation des milieux intérieurs, indiquez la ou les réponses exactes:
A. La vasopressine contrôle la quantité d'eau pure éliminée dans les urines par son effet
antidiurétique qui permet la réabsorption d'eau pure.
B. Le potassium est l'ion le plus important, il détermine les mouvements d'eau entre les
compartiments.
C. Le facteur natriurétique atrial FAN est un facteur d'origine pulmonaire qui favorise
l'élimination du sodium par les urines.
D. Le système rénine angiotensine aldostérone (SRAA) a un effet antidiurétique et
hypertenseur.
E. Si on a une diminution de la volémie/pression, on va avoir une augmentation de la
sécrétion de FAN et une diminution de l'action du sympathique.
Question 16:
Concernant l'électrophysiologie et ses principes physiques, indiquez la ou les réponses
exactes:
A. Un corps conducteur est un corps dans lequel les particules chargées (électrons, neutrons,
ions...) se déplacent librement, alors qu'un corps diélectrique est un corps isolant, capable
de contenir de l'énergie électrostatique.
B. L’électrostatique nous permet de comprendre et d'étudier le fonctionnement de la
membrane plasmique, des mécanismes de communication intercellulaire, ou encore
l'influence des phosphorylations sur les protéines.
C. L'électrocinétique permet quant à elle l'étude des charges en mouvement.

D. La loi de Coulomb énonce les propriétés de la force électrostatique : elle est radiale,
proportionnelle à la somme des charges et varie comme l'inverse du carré de la distance
entre les deux charges.
E. Un corps chargé soumis à un champ électrostatique est l'objet d'une force électrostatique
telle que : F = qE, avec E le champ de force créé par une charge électrique et q la charge
électrique.
Question 17:
Concernant l'électrophysiologie et ses principes physiques, indiquez la ou les réponses
exactes:
A. Le flux de champ électrostatique créé par une charge ponctuelle à travers une surface
élémentaire quelconque orientée dépend de l'angle solide à partir duquel est vue la
surface.
B. Une ligne de champ est tangente en tout point au champ électrostatique, et orientée dans
le sens opposé à ce champ.
C. Les surface équipotentielles correspondent aux points de l'espace (x, y, z) pour lesquels le
potentiel électrostatique est identique. Ce sont des sphères centrées sur la charge
électrique (q).
D. Les lignes de champ sont ainsi perpendiculaires aux surfaces équipotentielles et orientées
dans le sens du potentiel électrostatique croissant.
E. Dans le cadre d'un dipôle électrostatique, le potentiel électrostatique créé, au même
endroit, en présence de deux charges égales q, est nul.
Question 18:
Concernant l'électrophysiologie et ses applications et ses techniques de mesure, indiquez
la ou les réponses exactes:
A. Dans la physiologie de l'influx cardiaque, la contraction ventriculaire précède la contraction
auriculaire, du fait du chemin emprunté par cet influx, lui-même né de façon périodique au
niveau du nœud sinusal.
B. Dans le cadre de la dépolarisation d'un groupe de fibres, si le front de dépolarisation se
dirige vers le point d'enregistrement (P), P voit l'extrémité négative du dipôle s'approcher, et
donc son potentiel devenir de plus en plus négatif.
C. L'axe de dérivation est la droite reliant les deux points (très éloignés du cœur) entre
lesquels est enregistrée la différence de potentiel (ddp), et sur laquelle est projeté le
vecteur dipolaire instantané. Cette ddp sera elle même proportionnelle au module de ce
vecteur.
D. Une dérivation bipolaire mesure une ddp entre deux électrodes équidistantes du cœur,
alors qu'une dérivation unipolaire mesurera une ddp entre une électrode exploratrice et une
électrode indifférente (de potentiel constant) pour référence.
E. E) La théorie d'Einthoven permet d'expliquer les tracés observés dans les dérivations
périphériques. La première hypothèse stipule qu'à chaque instant, le potentiel créé par le
cœur en voie de dépolarisation ou de repolarisation peut être assimilé à celui créé par un
dipôle unique en milieu conducteur homogène.
Question 19:
Concernant les rayonnements en médecine, indiquez la ou les réponses exactes:
A. Une onde progressive sinusoïdale est une onde dont la source engendre la perturbation
d'une grandeur chimique qui varie dans le temps suivant une fonction sinus ou cosinus.
B. Le rayonnement électromagnétique est un mode de transport de la matière dans l'espace.
C. Un rayonnement électromagnétique est uniquement caractérisé par: sa fréquence ν, son
énergie E= h.ν , sa période T = 1/ ν , et sa longueur d'onde λ .
 6
6
 7
7
 8
8
 9
9
1
/
9
100%