Bases fondamentales Rôle de la ghréline dans la régulation de la

Bases fondamentales
Rôle de la ghréline
dans la régulation
de la motricité
gastro-intestinale
Inge Depoortere
Centre de recherche de gastéroentérologie, Gasthuisberg, O&N, B-3000 Leuven,
Belgique
Mots clés : ghréline, motricité gastro-intestinale, libération de l’hormone de
croissance, complexe moteur migrant
Il y a plus de cent ans, il avait été déjà montré que les extraits
hypophysaires étaient capables de stimuler la croissance, mais il a
fallu attendre 1971 pour que l’hormone de croissance (GH) soit
isolée [1]. La Growth Hormone Releasing Hormone (GHRH), le facteur
responsable de la libération de GH, a été identifiée uniquement en 1982
non pas dans le cerveau mais à partir d’une tumeur pancréatique [2].
Durant la même période, de nombreux autres peptides ont été découverts
et ont été testés sur leur capacité à stimuler l’axe hypothalamo-
hypophysaire. Il a été montré que les enképhalines (des pentapeptides)
pouvaient modifier la libération d’hormones à partir de l’hypophyse, y
compris les hormones lutéinisantes ou la TSH. Cependant, Bowers et al ont
découvert en 1977 qu’un seul analogue des enképhalines était suscepti-
ble de réguler la libération de GH [3]. Ces peptides ont été dénommés
Growth Hormone Secretagogue (GHS). En 1984, des travaux supplémen-
taires ont permis à cette équipe de mettre au point des peptides bien plus
efficaces, incluant le Growth-Hormone Releasing Peptide-6 (GHRP-6) mais
cette découverte est passée inaperçue de la communauté scientifique à
cause de l’isolement simultané du GHRH [4]. Le dogme que la sécrétion
de GH par l’hypophyse antérieure était le résultat net des actions
antagonistes de deux hormones hypothalamiques, le GHRH et la soma-
tostatine, a du être abandonné à mesure qu’il est devenu évident que le
mécanisme d’action du GHRP-6 sur la sécrétion de GH ne pouvait pas être
expliqué par ce modèle. Ceci a conduit certaines compagnies pharma-
ceutiques à développer des analogues du GHRP-6 actifs oralement et qui
avaient une efficacité plus importante et une meilleure biodisponibilité.
L’un de ces nouveaux composés non peptidique, le MK-0677 [5] a permis
la découverte et le clonage des récepteurs au GHS (le GHS-R) [6]. Il s’agit
d’un récepteur classique transmembranaire à 7 domaines, couplé aux
protéines G. Le gène du GHS-R code une protéine composée de 366
acides aminés, il est largement conservé durant l’évolution. Les études
s’intéressant à la distribution du GHS-R ont montré une concentration
élevée de ce récepteur dans la région hypothalamo-hypophysaire mais
également une présence importante au niveau périphérique, dans les
tissus endocrines et non endocrines [7] suggérant des fonctions assez
larges du GHS-R, bien au-delà du contrôle de la sécrétion de GH.
Hépato-Gastro, vol. 12, n° 3, mai-juin 2005
Tirés à part : I. Depoortere
219
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 24/05/2017.

Découverte de la ghréline
Sur la base de ces connaissances, le ligand endogène
du GHS-R a été découvert en 1999 par un groupe
japonais actif dans la recherche cardiovasculaire,
s’intéressant à l’action vasculaire du GHS synthétique
[8]. Le succès de ce groupe a été largement dû au fait
que ces chercheurs ont testé l’effet de différents extraits
provenant de différents tissus sur la libération de cal-
cium sur une lignée cellulaire exprimant le GHS-R.
L’activation la plus importante du GHS-R était observée
à partir d’extraits provenant de l’estomac, et n’était pas
retrouvée dans l’hypothalamus. Le ligand purifié, la
ghréline, est un peptide de 28 acides aminés dans
lequel la sérine en position 3 est octanoïlée. Cette
modification post-translationnelle unique est essentielle
pour l’effet de la ghréline sur la libération de GH et la
prise alimentaire. Cependant, la ghréline non acéty-
lée, qui circule en plus grande quantité que la forme
acétylée, est également biologiquement active et capa-
ble d’exercer des actions non endocrines y compris les
effets cardiovasculaires et antiprolifératifs probable-
ment en se liant à différents sous-types du récepteur
GH-S. Récemment, plusieurs autres molécules dérivées
de la ghréline ont été isolées ; il s’agit de protéines de
27 ou 28 acides aminés pouvant être classées en 4
groupes dépendant du type de l’acétylation (non acé-
tylée, octanoï-acétyle, décanoyacétylée et décénacéty-
lée) observé sur la sérine 3 [9].
La découverte de la ghréline est un exemple type de
pharmacologie inverse débutant au niveau des analo-
gues synthétiques et arrivant au ligand naturel après la
découverte du récepteur physiologique.
En fait, la ghréline a été également identifiée presque
simultanément par un autre groupe qui l’avait nommée
« motilin related peptide » [10]. Ces auteurs ont mon-
tré que la motiline et que le « motilin related peptide »
avaient un type d’expression complémentaire (cellules
endocrines intestinales et gastriques respectivement) et
ont suggéré que le « motilin related peptide » pouvait
également fonctionner comme une hormone gastrique.
Compte tenu du fait que ce groupe a déterminé la
séquence d’acides aminés à partir de la séquence
nucléotidique du précurseur, ils n’ont pas pu identifier
le phénomène d’octanoïlation. C’est pour cette raison
que cette hormone a été dénommée ghréline (GHRE est
la racine proto-indo-européenne du mot « growth »).
En plus des similarités structurelles des peptides, d’une
identité de 25 % des acides aminés et d’une identité de
l’organisation des précurseurs, les récepteurs de ces
hormones montrent une homologie de séquence très
marquée avec une identité à 44 %, augmentant à
87 % dans la région transmembranaire. Les récepteurs
à la motiline et à la ghréline constituent une nouvelle
sous-famille au sein des récepteurs couplés aux
G-protéines.
Effets de la ghréline
sur la motricité gastro-intestinale
La motiline a aussi été appelée « hormone de la faim »,
parce qu’une augmentation des concentrations plas-
matiques de motiline durant la période de jeûne
déclenchait des contractions intenses débutant dans
l’estomac et migrant distalement, la phase III du com-
plexe moteur migrant (CMM). Qui plus est, l’adminis-
tration exogène de motiline est capable de déclencher
une phase III prenant son origine dans l’estomac et
migrant distalement chez l’homme et chez le chien.
Compte tenu des homologies de séquences entre la
motiline et la ghréline, et de leurs récepteurs respectifs,
il est tentant de spéculer que la ghréline pourrait aussi
moduler la motricité gastro-intestinale et induire un
CMM. En effet, dans une étude récente, il a été montré
que l’injection intraveineuse de 40 lg de ghréline chez
le volontaire sain, 20 minutes après la survenue d’une
phase III du CMM, induisait prématurément une nou-
velle phase III en moyenne 14 ± 4 minutes après
l’injection avec une origine gastrique chez tous les
sujets étudiés (6/6) [11]. Après l’injection de sérum
physiologique, la phase III suivante était observée
75 ± 21 minutes et avait une origine gastrique chez
seulement 2 sujets sur 6. L’injection de ghréline était
accompagnée d’une augmentation du tonus gastrique.
Il y a plus de 10 ans, il a été montré que l’érythromy-
cine pouvait accélérer la vidange gastrique chez des
patients ayant une gastroparésie diabétique en intera-
gissant avec le récepteur à la motiline [12, 13]. Des
effets similaires ont été obtenus après l’injection de
motiline dans le même sous-groupe de patients [14].
Ainsi, l’observation de Trudel et al. (15) démontrant
que l’administration de ghréline accélérait la vidange
gastrique d’un repas liquide marqué chez le rat cons-
cient non opéré, de manière dose-dépendante, ne fut
pas une surprise. Dans ce modèle, la ghréline accélère
également le transit intestinal mais n’a pas d’effet sur le
transit colique. Dans une étude similaire, il a été
démontré que le GHRP-6 accélérait la vidange gastri-
que et le transit chez le rat [16]. Qui plus est, chez le rat
avec un iléus postopératoire, la ghréline permettait de
corriger le retard de vidange gastrique [15]. Nous
avons récemment développé une méthode non inva-
sive basée sur un test respiratoire à l’acide
14
C-
octanoïque pour mesurer la vidange gastrique chez la
souris et nous avons montré que la vidange des solides
était accélérée par les agonistes du GHS-R, la ghréline
et le GHRP-6 (figure 1). Les effets sur la vidange
gastrique chez l’homme n’ont pas été étudiés mais
Bases fondamentales
Hépato-Gastro, vol. 12, n° 3, mai-juin 2005
220
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 24/05/2017.

Tschop et al. [17] ont montré que le temps de demi-
vidange gastrique mesuré par un test respiratoire était
corrélé avec les concentrations plasmatiques de ghré-
line à jeun.
Deux problèmes se posent pour interpréter ces résul-
tats : les effets moteurs de la ghréline peuvent-ils être
dus à une interaction avec le récepteur à la motiline et
ces effets moteurs sont-ils médiés par des interactions
avec le plexus myentérique ou selon l’axe cérébro-
digestif (brain-gut axis)?
Le modèle d’antre gastrique de lapin est un modèle
classique in vitro pour étudier la motiline et est égale-
ment utile pour étudier les interactions entre la ghréline
et les récepteurs à la motiline. Il a été montré par des
études de récepteurs que la ghréline et les analogues
de la ghréline interagissaient très faiblement avec les
récepteurs à la motiline (IC50 supérieure à 60 lM)
alors que l’agoniste du récepteur à la ghréline, le
GHRP-6 avait une certaine affinité (IC
50
:3lM) (figure
2a) (18). Des études menées sur les cellules CHO-K1
exprimant le récepteur à la motiline et l’apoaequorine
ont montré que ni la ghréline ni le GHRP-6 n’étaient
capables d’induire une réponse bioluminescente avec
libération de calcium à des concentrations allant
jusqu’à 10
-4
M(figure 2b).
Aucun résultat n’a permis de montrer que la ghréline,
jusqu’à des concentrations allant à 10
-5
M, stimulait la
motricité par une voie locale sur des préparations de
muscles antraux du lapin. À l’inverse sur ces prépara-
tions, le GHRP-6 à des concentrations 10
-5
M augmen-
tait la réponse contractile nerveuse déclenchée par des
stimulations électriques, partiellement par l’interaction
avec le récepteur à la motiline et des nerfs non choli-
nergiques médiés par des tachykinines, partiellement
via un autre récepteur qui pourrait être un sous-type du
récepteur GHS-R situé sur les nerfs cholinergiques coli-
bérant les tachykinines [18]. Les différences de réponse
observées entre la ghréline et le GHRP-6 chez le lapin
suggèrent que le GHS-R et le récepteur à la motiline, et
leur ligand la ghréline et la motiline, pourraient faire
25
50
75
100
Temps (min)
0
t1/2 = 33 min
t1/2 = 83 min
040 80 120 160 200 240 280
% Dose/h
Figure 1.Effet de la ghréline (intra-péritonéal) sur la vidange gas-
trique (mesurée par un test respiratoire au
14
C acide octanoïque)
chez la souris. Après une nuit de jeune, les souris ont reçu 250 lg/kg
de ghréline (•) ou du sérum physiologique (♦). Trente minutes après
les souris ont reçu un repas contenant de l’acide
14
C octanoïque. Le
14
CO
2
était recueilli dans l’air expiré et mesuré et exprimé en temps
que pourcentage de l’expression par heure de
14
C ingéré. L’injection
de ghréline accélérait le temps de demi-vidange de 83 minutes à 33
minutes.
0
25
50
75
100
125
0
25
50
75
100
125
Motiline Motiline
GHRP-6
GHRP-6
Ghréline
Ghréline
Log M
A
% Specific Binding
Ca2+ Luminescence
B
- 11 - 10 - 9 - 8 - 7 - 6 - 5 - 4 - 12 - 10 - 8 - 6 - 4
Log M
Figure 2.Interactions de la ghréline avec le récepteur à la motiline. A) Etudes de liaison avec le récepteur de la motiline réalisées en mettant
en présence des membranes de cellules antrales de lapin, de la 125I-motiline et des concentrations variables de motiline non marquée, de
Ghréline ou de GHRP-6. B) Réponse luminescente au calcium obtenue après administration de motiline, de ghréline et de GHRP-6 à des cellules
CHO-K1 exprimant le récepteur humain à la motiline et l’apoaequorine, un indicateur luminescent de libération de calcium.
Hépato-Gastro, vol. 12, n° 3, mai-juin 2005 221
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 24/05/2017.

partie d’une famille plus grande avec d’autres peptides
et récepteurs restant à découvrir.
À l’inverse du lapin, chez le rat, à la fois la ghréline et
le GHRP-6 –– mais pas la motiline –– sont capables de
modifier les contractions gastriques in vivo. Des études
in vitro ont montré que la ghréline et le GHRP-6 aug-
mentaient les contractions d’origine nerveuse mais ne
modifiaient pas la contraction musculaire lisse à des
concentrations équivalentes sur des préparations de
fundus et d’antre, ceci par des voies cholinergiques qui
sont masquées en partie par des voies nitrergiques
[16]. Compte tenu du fait que la motiline n’a jamais été
isolée chez le rat, malgré de nombreuses tentatives, il
est donc tentant d’émettre l’hypothèse que la ghréline
pourrait remplacer la motiline dans cette espèce.
L’existence de transcripts d’ARN messager pour la
ghréline et le récepteur à la ghréline dans le système
nerveux entérique de lapin et du cobaye a été confir-
mée par des études en RT-PCR [18, 19]. Les bases
morphologiques démontrant l’existence de ghréline
dans le plexus myentérique ont été confirmées par des
études en immunohistochimie sur des coupes longitudi-
nales de muscles contenant des plexus myentériques et
sur des cultures de neurones provenant de l’iléon du
cobaye [19]. À l’inverse de la motiline, la ghréline était
principalement colocalisée avec des neurones immuno-
réactifs pour l’acétylcholine mais pas pour la calbidine
et nNOS. En utilisant des techniques sophistiquées,
Bisschops et al. [20] ont montré que la ghréline et le
GHRP-6 activaient un sous-groupe de neurones myen-
tériques dans l’intestin grêle de cobaye. Ces réponses
sont dues à l’activation directe des neurones et sem-
blent être liées à la libération de calcium à partir du
stock intracellulaire.
En plus de ces effets locaux, Masuda et al. [21] ont
montré que l’effet excitateur de la ghréline sur la
fréquence et l’amplitude des contractions gastriques
chez le rat anesthésié pouvait être bloqué par l’atro-
pine et la vagotomie, suggérant que la ghréline péri-
phérique pouvait également activer un réflexe vago-
vagal. Ces données ont été confirmées [22]. Ces
auteurs ont montré une expression de l’ARN messager
du GHS-R dans les ganglions nerveux de rat par une
technique de RT-PCR et d’hybridation in situ et ils ont
également montré la présence d’ARN messager pour le
GSH-R et des cellules produisant le GHS-R dans les
ganglions nerveux de rat. Qui plus est, il a été montré
que le récepteur à la ghréline était synthétisé dans le
corps cellulaire des afférences vagales et transporté à
la périphérie, indiquant qu’il existait une proximité
étroite entre les cellules produisant de la ghréline et les
terminaisons vagales au niveau de l’estomac. Des
études électrophysiologiques ont montré que la ghré-
line diminuait l’excitation des afférences vagales alors
qu’un peptide comme la CCK, qui transmet un signal
de satiété au niveau du noyau du tractus solitaire par
des afférences vagales, les excitait [23]. Ces études
confirment que la ghréline permet la transmission de
signaux de l’estomac vers le cerveau via des afférences
vagales. Chez la souris, Asakawa et al. [24] ont
également montré que la ghréline accélérait la vidange
gastrique après une administration centrale, suggérant
que la libération centrale de ghréline pouvait jouer un
rôle dans la régulation de la motricité gastrique en
modulant les efférences vagales. Les hypothèses qu’il
reste à explorer concernent la part respective de la
ghréline hypothalamique versus la ghréline d’origine
gastrique, ou des deux, dans la régulation de la
motricité gastrique.
En résumé, la ghréline et le GHS ont le potentiel pour
jouer un rôle dans la régulation de la motricité gastro-
intestinale au niveau des neurones myentériques, mais
pas au niveau des cellules musculaires lisses. Cet effet
est dépendant de l’espèce et des interactions croisées
avec le récepteur à la motiline peuvent survenir unique-
ment avec certains agonistes du GHS-R à des concen-
trations élevées. Qui plus est, la ghréline périphérique
peut également activer un réflexe vago-vagal pour
stimuler la motricité gastrique alors que la ghréline
centrale agit par des efférences vagales périphériques.
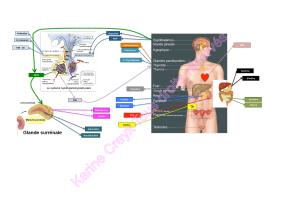
Une représentation schématique du mécanisme
d’action de la ghréline est rapportée sur la figure 3.
Autres effets biologiques
de la ghréline
Bien que ce ne soit pas le but de cette mise au point,
d’autres effets de la ghréline, principalement sur la
sécrétion de GH et sur la balance énergétique doivent
être signalés.
Effets sur la sécrétion de GH
La ghréline provoque une libération directe de GH in
vitro à partir de glandes hypophysaires du rat [8] et
possède une forte activité dose-reliée sur la libération
de GH lorsqu’elle est administrée par voie systémique
chez le rat [22] et l’homme [25]. Il a aussi été montré
que la ghréline pouvait stimuler la libération de GH
lorsqu’elle est administrée au niveau du système ner-
veux central par certains auteurs [22] mais pas par tous
[26], suggérant un site d’action central. L’effet de la
ghréline sur la sécrétion de GH n’est pas cependant,
spécifique de la GH car la ghréline stimule également
la libération d’hormones lactotrophiques et corticotro-
phiques. La co-administration de ghréline avec le
GHRH, mais pas avec des analogues synthétiques
GHS, avait un effet synergique sur la sécrétion de GH
chez l’homme, suggérant une action pharmacologique
différente [25]. Cependant, Tannebaum et al. [26] ont
Bases fondamentales
Hépato-Gastro, vol. 12, n° 3, mai-juin 2005
222
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 24/05/2017.

démontré que la sécrétion de GH induite par la ghré-
line in vivo nécessitait la présence d’un système GHRH
endogène intact car l’immunoneutralisation de la
GHRH endogène bloquait presque totalement la
réponse de GH à l’injection de ghréline. Des études
anatomiques suggèrent que la ghréline peut directe-
ment moduler l’ARN messager du GHRH et les ARN
messagers du neuropeptide Y au niveau de neurones
du noyau arqué de l’hypothalamus, mais pas au
niveau des cellules exprimant l’ARN messager du SRIF.
Ainsi, la ghréline n’agit pas en modifiant la libération
de somatostatine hypothalamique, mais stimule plutôt
la libération de la GH par des voies dépendantes de la
GHRH.
Effet sur la balance énergétique
L’administration de ghréline chez le rongeur provoque
une prise de poids [26, 27]. Cet effet est dose-
dépendant et est plus important après une administra-
tion centrale qu’après une administration périphérique
[27]. Les études chez les rongeurs ont montré que
l’administration de ghréline générait une balance éner-
gétique positive et augmentait les adipocytes en stimu-
lant les ingestions alimentaires et en diminuant l’utilisa-
tion de graisses [26, 27]. Chez l’homme, la ghréline
augmente l’appétit et augmente la prise alimentaire
[28]. Qui plus est, les taux circulants de ghréline sont
diminués de manière chronique au cours de l’obésité
[29] et lors des ingestions de calories [30] conduisant
à une balance énergétique positive. Cependant les
concentrations plasmatiques de ghréline sont augmen-
tées par le jeune [30] et chez les patients cachectiques
ayant une anorexie mentale [31]. Ces études confir-
ment que la ghréline pourrait être une hormone signa-
lant la nécessité de conserver de l’énergie.
Il est clair que la ghréline interagit avec de très nom-
breux neurones hypothalamiques contenant des pepti-
des orexigènes (NPY/AGR et neurones oréxigènes)
permettant de réguler le comportement alimentaire et
l’homéostasie énergétique [26, 24, 32, 33]. Les voies
impliquées sont probablement différentes si la ghréline
est administrée par voie intracérébroventriculaire ou
par voie périphérique. L’étude de Date et al. [23] a
montré que la capsaïcine et la vagotomie bloquaient la
prise alimentaire induite par une administration péri-
phérique de ghréline, mais ne modifiait pas la prise
alimentaire induite par l’administration centrale de
ghréline. Ceci suggère que les afférences gastriques
vagales sont la voie principale de transmission du
signal de ghréline pour obtenir l’arrêt de la prise
alimentaire et induire la sécrétion de GH par le cer-
veau.
Autres effets
L’injection intraveineuse de ghréline diminue significa-
tivement la tension artérielle sans modifier le pouls et
augmente le débit cardiaque chez le volontaire sain et
chez les patients ayant une insuffisance cardiaque [34,
35]. Une inhibition de l’apoptose des cellules cardia-
ques et des cellules endothéliales par la ghréline peut
contribuer aux actions cardioprotectrices de la ghré-
line [36]. Des effets antiprolifératifs de la ghréline ont
été observés sur des cellules néoplasiques [37]. Une
étude récente a montré que la ghréline favorisait le
sommeil profond chez l’homme [39].
Conclusions
La ghréline et le GHS ont le potentiel pour jouer un rôle
important dans la régulation de la motricité gastro-
intestinale au niveau des neurones myentériques et en
stimulant des réflexes vago-vagaux.
La ghréline est le peptide oréxigène le plus important
au niveau périphérique et il pourrait s’agir d’une molé-
cule signalant le besoin d’un anabolisme en cas de
DMV
Ghréline
Ghréline
NTS
Ganglion
nerveux
Figure 3.Représentation des sites d’actions de la ghréline permet-
tant la stimulation de la motricité gastrique. La ghréline périphérique
a un effet direct sur le plexus myentérique mais stimule également un
réflexe vago-vagal permettant la modulation de la motricité gastri-
que. Qui plus est, la ghréline centrale peut également agir via des
efférences vagales.
Hépato-Gastro, vol. 12, n° 3, mai-juin 2005 223
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 24/05/2017.
 6
6
1
/
6
100%