Exploration des corticosurrénales

Exploration biochimique des
corticosurrénales
Exploration biochimique des
corticosurrénales
Professeur Layachi Chabraoui
Cours de biochimie 2ème Année Médecine Rabat 2010-2011

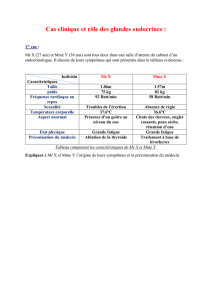
1- Les hormones corticosurrénaliennes1- Les hormones corticosurrénaliennes
Les corticosurrénales secrètent trois types d’hormones
stéroïdes
• Les glucocorticoïdes dont le chef de file est le Cortisol:
formés essentiellement au niveau de la zone fasciculée
(zone intermédiaire qui occupe 80% de la glande)
(zone intermédiaire qui occupe 80% de la glande)
• Les minéralocorticoïdes dont le représentant est
l’Aldostérone secrétés par la zone glomérulée (la plus
externe: 15%)
• Les androgènes, surtout la déhydroépiandrostérone
(DHA) formés dans la zone réticulée (5%).

Biosynthèse des hormones stéroïdesBiosynthèse des hormones stéroïdes
• Elle se fait au niveau de chaque zone à partir du
cholestérol.
• Les esters sulfates de stéroïdes sont formés surtout
dans la zone réticulée, il s’agit surtout de l’ester sulfate
dans la zone réticulée, il s’agit surtout de l’ester sulfate
de DHA qui est le principal stéroïde plasmatique
• Le cholestérol qui sert à la biosynthèse peut être
synthétisé sur place à partir de l’acétyl-CoA ou
apporté par les LDL

Structures du cholestérol et Structures du cholestérol et
du cortisoldu cortisol
Structures du cholestérol et Structures du cholestérol et
du cortisoldu cortisol
HOCH2 .
HO OH
Cortisol
en C21
Cholestérol
en C27 18 20
21 22
23
24
25
26
27
1
2
345
10
67
8
9
11 12 13
14 15
16
17
19
26

Zone Glomérulée
Cholestérol
Prègnenolone
ProgestéroneProgestérone
17-OH-Prègnenolone
1717--OHOH--PP
DHEA
∆4-A
P450scc
P450c21
21
-
Hydroxylase
P450c17
3ß-HSD
Cholestérol
Prègnenolone
Progestérone
Zones Fasciculée et Réticulée
17-20
Desmolase
DOC
Corticostérone
18-OH-Corticostérone
Aldostérone
11-Désoxycortisol
Cortisol
21
-
Hydroxylase
P450c11
11 β
ββ
βOH
P450c18
DOCDOC
Corticostérone
P450scc = 20, 22 OHase + 20-22 Desmolase
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
1
/
39
100%