1 LES COMBUSTIONS I) La combustion du carbone

1
LES COMBUSTIONS
I) La combustion du carbone.
Dans un barbecue, le charbon de bois brûle et produit la chaleur nécessaire à la cuisson des brochettes.
Pour aviver ou raviver le foyer, on peut souffler ou brasser l’air au-dessus du barbecue. Le charbon brûle
alors plus fort. Pourquoi ?
Réponse :brasser l’air ou souffler permet au carbone de réagir avec plus d’air ; la combustion est alors
plus efficace.
1. La combustion du carbone dans l’air :
Le carbone est un élément chimique abondant sur la Terre. Il entre dans la composition de tous les êtres
vivants. Le charbon de bois et le fusain (utilisé en dessin) sont essentiellement constitués de carbone.
Étudions les propriétés de la combustion du carbone dans l’air.
Nous savons déjà que lorsque l’on fait brûler du carbone dans l’air, de la chaleur est dégagée
Réalisons la combustion du charbon de bois.
Protocole : nous plaçons un morceau de charbon de bois incandescent dans un flacon fermé.
Observation : au bout d’un certain temps, le charbon de bois ne brûle plus. De plus, en réagissant avec
l’air, la quantité de carbone diminue.
Interprétation :
Le carbone (combustible) a donc besoin d’un ou de plusieurs corps chimiques présents dans l’air pour
brûler.
Question : l’air est un mélange de gaz, composé essentiellement de dioxygène et de diazote. Lequel de ces
deux gaz est nécessaire à la combustion du carbone ?
2. La combustion du carbone dans le dioxygène :
Pour répondre à cette question, réalisons la combustion du carbone dans un flacon rempli de dioxygène.
Protocole : nous plaçons un fusain incandescent (rouge) dans un flacon rempli de dioxygène qui est
ensuite fermé.
Observation : la combustion est alors très vive, le fusain se consume plus rapidement que dans l’air. Au
bout d’un certain temps, la combustion s’arrête alors qu’il y a encore du fusain. Si nous remplissons à
nouveau le flacon de dioxygène, la combustion redémarre.
Interprétation :
C‘est le dioxygène de l’air qui permet la combustion du carbone. C’est le comburant
3. La combustion du carbone : une transformation chimique
La combustion du carbone est une transformation chimique dans laquelle le carbone réagit avec le
dioxygène. Ces deux corps sont appelés les réactifs. Ils sont consommés par la combustion qui s’arrête
quand il manque l’un des deux réactifs.
Mais que deviennent donc le carbone et le dioxygène ?
Après la combustion, il reste un peu de cendres mais la masse des cendres obtenues est nettement
inférieure à la masse du fusain avant la combustion. Ces cendres sont composées de la part du fusain qui
n’est pas du carbone.
Lors d’une réaction chimique, les réactifs réagissent entre eux pour donner un ou plusieurs autres corps
chimiques que l’on appelle les produits (ils sont produits par la réaction). La réaction entre le dioxygène et
le carbone ne donne qu’un seul produit, un gaz puisqu’on ne le voit pas. Nous allons chercher à le mettre
en évidence.

2
Le test du dioxyde de carbone : une fois la combustion effectuée, versons de l’eau de chaux dans le
flacon. L’eau de chaux se trouble. Le gaz produit par la réaction est donc du dioxyde de carbone.
Le bilan de la transformation chimique
Le bilan de cette transformation que l’on appelle combustion du carbone s'écrit :
Carbone + dioxygène dioxyde de carbone
Il se lit :du carbone et du dioxygène réagissent entre eux pour produire du dioxyde de carbone.
L'équation de la réaction de combustion du carbone s'écrit :
(C) + (O2)(CO2)
Que l’on peut écrire : C + O2CO2
Généralisation :
Les réactifs et les produits y sont écrits en toutes lettres. Les réactifs sont placés à gauche de la flèche ;
s’il y en a plusieurs, on les relie à l’aide d’un signe « + ». Une flèche symbolise la transformation des
réactifs (à gauche de la flèche) en produits (à sa droite). Un bilan ne décrit pas une transformation (il ne
dit pas si la réaction a lieu avec combustion ou si elle se passe dans l'eau) mais il précise quels sont les
corps chimiques initialement présents (réactifs) et en quels corps (produits) ils sont transformés.
II) La combustion du butane.
Pourquoi dit-on qu’un chauffage au gaz est moins sec qu’un chauffage électrique ? Pourquoi les avions
laissent-ils des traînées blanches dans le ciel ? À ces deux questions, on peut faire la même réponse.
Réponse : la combustion de nombreux combustibles (essence, gaz) produit de l’eau. C’est l’eau qui
constitue les traînées blanches laissées par les avions.
1. Les hydrocarbures :
Le butane, le propane et le méthane sont des hydrocarbures : ils ne sont constitués que d’atome
carbone et d’atome hydrogène.
À température ambiante et pression atmosphérique, le butane et le propane se présentent sous forme
gazeuse.
On les utilise comme combustible pour chauffer et parfois pour éclairer. Le méthane est le principal
constituant du gaz de ville, il est distribué par des canalisations dans les grandes agglomérations. Le
propane et le butane sont liquéfiés et conditionnés dans des bonbonnes.
2. Les réactifs de la combustion du butane :
Le gaz contenu dans les briquets est du butane. Quand il brûle, la flamme produite est bleue à sa base et
jaune à son sommet. Réalisons une expérience pour déterminer quelle substance réagit avec le butane lors
de sa combustion.
Protocole : plaçons un flacon au-dessus d’un briquet allumé.
Observation : le briquet s’éteint tout seul. Si nous introduisons une allumette enflammée dans le flacon,
elle s’éteint immédiatement.
Interprétation :
La combustion du butane a consommé le dioxygène contenu dans le flacon.
Les réactifs de la combustion du butane sont le butane et le dioxygène. Le butane est le combustible et
le dioxygène est le comburant.

3
3. Les produits de la combustion du butane :
Cherchons maintenant quelles substances ont été produites lors de la combustion.
a) Le test de l'eau :
Protocole : plaçons un bécher au-dessus de la flamme d’un briquet.
Observation : des gouttelettes de liquide apparaissent à la surface du verre. À leur contact, le sulfate de
cuivre anhydre en poudre bleuit.
Interprétation :
La combustion du butane produit de l’eau.
b) Le test du dioxyde de carbone :
Protocole : laissons un briquet allumé dans un flacon fermé. Une fois le briquet éteint, mettons de l’eau de
chaux dans le flacon.
Observation : l’eau de chaux se trouble mettant ainsi en évidence la présence de dioxyde de carbone.
Interprétation
La combustion du butane produit du dioxyde de carbone
4. Bilan de la transformation et applications :
Le bilan de la combustion du butane s’écrit :
Butane + dioxygène eau + dioxyde de carbone
L'équation de la combustion du butane s'écrit :
C2H6+ O2H2O + CO2
L’essence, le fuel et le gasoil sont constitués d’hydrocarbures. Comme la combustion du butane, les
réactions de combustion des autres hydrocarbures produisent de l’eau et du dioxyde de carbone.
Exemple :
La partie visible des gaz d’échappement d’une voiture est constituée d’eau. Elle est d’autant plus visible
que la température est basse (en hiver notamment).
5. Equilibrer l'équation d'une réaction chimique :
Ci-dessous, l'équation de la réaction de combustion du méthane n'est pas équilibrée :
(CH4) + (O2)(H2O) + (CO2)
Nous avons en effet :
Du côté des réactifs (avant la flèche) : 1atome carbone, 4atomes hydrogène et 2atomes oxygène.
Du côté des produits (après la flèche) : 1atome carbone, 2atomes hydrogène et 3atomes oxygène.
Cela voudrait dire que deux atomes hydrogène auraient disparu et qu'un atome oxygène serait apparu. CE
N'EST PAS POSSIBLE. Au niveau atomique, "rien ne se perd, rien ne se crée, tout se transforme"
(Lavoisier).
Il va donc nous falloir équilibrer la réaction.
Considérons d'abord les atomes hydrogène : il en manque deux du côté des produits de la réaction (à
droite de la flèche), nous allons donc ajouter une molécule d'eau qui apportera les deux atomes hydrogène
manquant. Nous obtenons donc:
(CH4) + (O2)2(H2O) + (CO2)

4
CH4+ O22H2O + CO2
Est-elle alors équilibrée ? Non car si nous avons bien 1atome carbone et 4atomes hydrogène de chaque
côté de la flèche, il n'y a, par contre, que 2atomes oxygène du côté des réactifs (à gauche de la flèche)
alors qu'il y en a 4du côté des produits (à droite de la flèche).
Que pouvons-nous faire ? Ajouter une molécule de dioxygène qui est composée de deux atomes oxygène
du côté des réactifs
(CH4) + 2(O2)2(H2O) + (CO2)
CH4+ 2O22H2O + CO2
Type d'atomes Du côté des réactifs Du côté des produits
Carbone de symbole C 1 1
Hydrogène de symbole H 4 4
Oxygène de symbole O 4 4
La réaction est donc bien équilibrée, tous les atomes qui étaient présents avant la réaction sont présents
après.
Rien ne s'est créé, nous n’avons pas crée ni détruit d’atomes. Les atomes des molécules qui composent
les réactifs se sont séparées et se sont ensuite recomposées en de nouvelles molécules, les produits,
mais en conservant le même nombre d’atomes qu’il avait au départ. Rien ne s'est perdu, tout s'est
transformé …
Lors d'une combustion, les corps purs mis en
présence (les réactifs) sont consommés et d'autres
corps purs (les produits) se forment.
La combustion est une réaction chimique. Le
dioxygène est le comburant, le réactif qui brûle est
le combustible.
Les combustions peuvent être dangereuses :
Lors d'une combustion complète, le
dioxygène est présent en quantité suffisante.
Lors d'une combustion incomplète, ce n'est
pas le cas et la combustion peut produire du
monoxyde de carbone qui est un gaz toxique.

5
L'essentiel à retenir absolument :
RESUME CHIMIE EQUATION
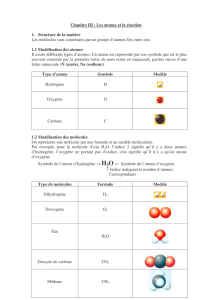
1. Symbole de l'atome
Un atome est symbolisé par une lettre majuscule seule ou par une majuscule suivie d'une minuscule.
Exemples :
Atome de carbone : C ; atome d'oxygène : O ; atome de zinc : Zn, atome de cuivre : Cu.
Ces symboles rappellent souvent le nom de l'atome.
Quelques exceptions :
Hg pour le mercure (ancien nom : Hydrargyre), N pour l'azote (ancien nom : Nitrogène).
2. Signification de la formule chimique
La formule brute d'une substance chimique nous renseigne sur sa composition. Elle précise la nature et le
nombre d’atomes qui constituent la substance. A l'intérieur d'une formule brute, le chiffre qui se trouve
en indice à la suite du symbole d'un atome ne supplique qu'à cet atome.
Lorsqu’aucun chiffre n'est indiqué, il faut considérer que le chiffre 1 est présent.
Exemple :
La molécule d'eau, de formule brute H2O, contient toujours deux atomes hydrogène et un atome oxygène.
Le dioxyde de carbone de formule brute CO2pourrait s'écrire C102la molécule compte un atome carbone
pour deux atomes oxygène.
3. Les corps simples et les corps composés
Un corps simple est constitué d'un seul type d'atome. Dans le cas contraire, on parle de corps composé.
Il existe :
- des corps purs simples, constitués d'un seul type de molécules contenant un seul type d'atome ;
Exemple : le dihydrogène pur H2.
- des corps purs composés, formés d'un seul type de molécules constituées d'atomes différents.
Exemple : l'eau pure H2O.
LA RÉACTION CHIMIQUE
1. Transformation de la matière
Au cours d'une transformation chimique, des espèces chimiques sont transformées en d'autres
espèces.
Les corps présents avant la transformation, et qui vont réagir entre eux, sont les réactifs ; les corps
formés sont les produits.
Les atomes qui constituent les réactifs se réarrangent pour donner les produits. Les atomes eux-
mêmes ne sont pas modifiés.
Une réaction chimique ne crée pas d'atomes. De la même manière, elle n'en détruit pas.
2. Équation d'une réaction
On représente une réaction chimique par une équation dans laquelle on écrit d'abord la formule brute des
réactifs, puis la formule brute des produits.
Réactifs et produits sont séparés par une flèche qui indique le sens de la réaction chimique.
Exemple :
Équation de la formation du dioxyde de carbone par combustion du carbone
C + 02CO2
Carbone Dioxygène Dioxyde de carbone
Réactifs Produit
Tous les atomes présents dans les réactifs doivent se retrouver dans les produits.
Inversement, les produits ne sont constitues que d'atomes présents avant la réaction dans les réactifs.
Pour traduire cette conservation des atomes, une équation de la réaction chimique doit être équilibrée.
Pour équilibrer l'équation, on place des coefficients devant les formules des réactifs ou des produits.
 6
6
1
/
6
100%