Chapitre . Les atomes et la réaction chimique.

Chapitre III : Les atomes et la réaction
1. Structure de la matière
Les molécules sont constituées par un groupe d’atomes liés entre eux.
1.1 Modélisation des atomes
Il existe différents types d’atomes. Un atome est représenté par son symbole qui est le plus
souvent constitué par la première lettre du nom écrite en majuscule, parfois suivie d’une
lettre minuscule (N (azote), Na (sodium)).
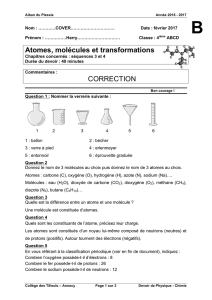
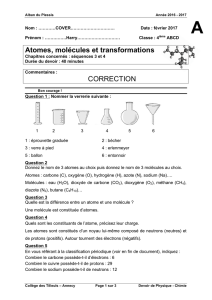
Type d’atome Symbole Modèle
Hydrogène
H
Oxygène
O
Carbone
C
1.2 Modélisation des molécules
On représente une molécule par une formule et un modèle moléculaire.
Par exemple, pour la molécule d’eau H2O, l’indice 2 signifie qu’il y a deux atomes
d’hydrogène, l’oxygène ne portant pas d’indice, cela signifie qu’il n’y a qu’un atome
d’oxygène.
Symbole de l’atome d’hydrogène →
H2O
←
Symbole de l’atome d’oxygène
↑ Indice indiquant le nombre d’atomes
Correspondants
Type de molécules Formule Modèle
Dihydrogène
H2
Dioxygène
O2
Eau
H2O
Dioxyde de carbone
CO2
Méthane
CH4

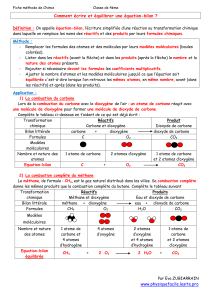
2. Interprétation de la combustion du carbone
Représentons les réactifs et les produits du bilan obtenu lors de la combustion complète du
carbone par des modèles moléculaires.
Réactifs Produits
Bilan carbone + dioxygène →
dioxyde de carbone
Modèles
+
→
Equation bilan
C + O2 → CO2
Lors d’une réaction chimique, les atomes se réarrangent mais ne disparaissent pas.
Cependant, il faut s’assurer que l’équation bilan est équilibrée, c’est-à-dire que les mêmes
atomes figurent en même nombre dans les réactifs et dans les produits. Nous allons l’illustrer
dans le paragraphe suivant.
3. Interprétation de la combustion du méthane
méthane + dioxygène →
→→
→ dioxyde de carbone + eau
+ →
→→
→ +
CH4 + 2 O2 →
→→
→ CO2 + 2 H2O
4. Conservation de la masse
En 1777, Lavoisier montra que au cours d’une réaction chimique:
La masse des réactifs disparus est égale à la masse des produits formés.
Cette loi de conservation est une conséquence directe de la conservation des atomes.

5. Activité (conservation de la masse)
5.1 Réaction entre le calcaire et l’acide chlorhydrique
On observe une effervescence: un gaz se dégage qui trouble l’eau de chaux.
Conclusion : L’acide chlorhydrique réagit avec le calcaire pour donner divers produits,
dont du dioxyde de carbone.
5.2 Mesure de la masse du système réactif lors de la réaction
Observations:
• La masse finale reste égale à la masse initiale
• Quand on débouche le flacon, la masse diminue, car le dioxyde de carbone qui fait
partie des produits formés s’échappe.
Conclusion:
Au cours d’une réaction chimique, la masse se conserve. La masse des produits est égale
à la masse des réactifs.
1
/
3
100%