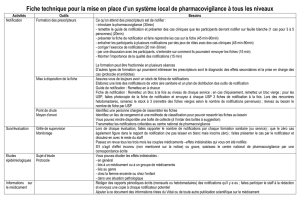
assurance qualité en pharmacovigilance

ÉVALUATION DE LA QUALITÉ
D’UNE NOTIFICATION
A.TEBAA
2éme Cours francophone inter-pays de
Pharmacovigilance
Rabat; 2-6 juin 08

INTRODUCTION
L’augmentation constatée, d’année en année, du nombre de
notifications spontanées induit naturellement une augmentation
de l’activité des services de Pharmacovigilance, ainsi l’obligation
d’assumer de « façon permanente et continue »
la responsabilité de Pharmacovigilance devient de plus en plus
contraignante et complexe.

ASSURANCE QUALITE
“Toutes les dispositions prises pour assurer la
qualité d’un médicament depuis son
développement jusqu’à son utilisation par le
patient”.
AQ = Système Collectif pour garantir
• la qualité, la sécurité et l’efficacité et s’assurer
que le médicament est adapté à l’usage auquel
il est destiné…

ASSURANCE QUALITÉ EN PHARMACOVIGILANCE
• Somme des activités et des responsabilités destinées à assurer que
les médicaments qui parviennent au patient sont sans danger,
efficaces et acceptables.
• Etape de surveillance et de promotion d’un usage rationnel
• Les bonnes pratiques de pharmacovigilance font partie de
l’assurance de la qualité
La Pharmacovigilance est bien un élément régulateur de la vie du
médicament dont on ne peut plus négliger la qualité

GESTION DES DONNÉES EN PHARMACOVIGILANCE
Data
processing
Inter-
pretation and
conclusions
Storage and
maintenance
Selection,
retrieval and
manipulation
Analysis and
assessment
Collection
and
data entry
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
1
/
37
100%