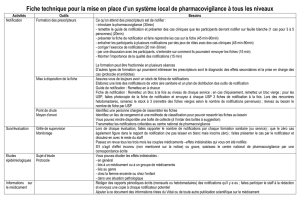
Togo : Manuel de pharmacovigilance doc, 794kb

1
M
Ma
an
nu
ue
el
l
d
de
e
P
Ph
ha
ar
rm
ma
ac
co
ov
vi
ig
gi
il
la
an
nc
ce
e
Vous pouvez sauver des milliers de vies et éviter la
souffrance de milliers. Il vous suffit de notifier spontanément
les effets secondaires liés à l’utilisation des médicaments.
Après avoir pris le médicament il a
mal au ventre et se gratte partout.
On va arrêter le traitement !?!
Retournez d’abord voir le
prescripteur ou le pharmacien.
Rappelez-lui de signalez les effets
indésirables au Centre National
de Pharmacovigilance

2
L
LE
ES
S
I
IN
NF
FO
OR
RM
MA
AT
TI
IO
ON
NS
S
A
AV
VA
AN
NT
T
L
LA
A
C
CO
OM
MM
ME
ER
RC
CI
IA
AL
LI
IS
SA
AT
TI
IO
ON
N
S
SO
ON
NT
T
L
LI
IM
MI
IT
TE
EE
ES
S
Au stade d’expérimentation chez l’animal :
Nombre d’animaux testés limité
Durée d’observation limitée
Données pharmacocinétiques et métaboliques pas toujours
extrapolables à l’HOMME
Certains effets propres à l'HOMME non détectés (troubles psychiques,
allergie…)
Au stade des essais cliniques (HOMME) :
Nombre de sujets inclus dans les essais cliniques limités < 5000
Sujets à risque écartés : enfant, vieillard, femme enceinte, insuffisance
rénale, insuffisance hépatique
Absence d’information sur les effets d’une prise chronique et
d'interactions médicamenteuses
Déroulement en milieu contrôlé

3
Définitions
La pharmacovigilance est « la science et les activités relatives à la détection, à
l'évaluation, à la compréhension et à la prévention des effets indésirables ou
de tout autre problème lié aux médicaments ».
L’importance de la pharmacologie (OMS 2002)
L’effet indésirable est un événement clinique ou biologique non recherché
coïncidant avec la prise d’un produit de santé et apparaissant dans les
conditions normales d’utilisation, ou en cas de :
– Mauvais usage
– Usage abusif
– Pharmacodépendance
– Syndrome de sevrage
– Erreur thérapeutique
– Inefficacité thérapeutique
– Effets sur le produit de conception
– Réactions résultant d’un produit défectueux
Intérêt de la notification spontanée
Il a fallu :
- plusieurs décennies pour que les effets délétères de l’aspirine sur le tractus
gastro-intestinal soient découverts
- presque aussi longtemps pour que l’on reconnaisse la possibilité de
nécroses papillaires rénales lors d’abus de phénacétine
- 35 ans pour que l’on reconnaisse que l’amydopyrine peut causer
l’agranulocytose
- Plusieurs victimes avant que l’imputabilité de la thalidomide dans la
phocomélie devienne certaine
Après la tragédie de la thalidomide, plusieurs pays ont établi un système de
pharmacovigilance pour une détection précoce et si possible la prévention de
morbidité et mortalité iatrogène.

4
Grâce à la notification spontanée de nombreux médicaments ont été vite
incriminés comme responsables d’effets graves et retirés du marché dans un
délai relativement court.
DCI
Motif du retrait
AMM
Retrait
Bromfenac (Duract®)
Hépatotoxicité sévère
1997
1998
Encaïnamide (Enkaid®)
Mortalité excessive
1987
1991
Flosequinan
(Manoplax®)
Mortalité excessive
1992
1993
Temafloxacine
(Omniflox®)
Anémie hémolytique
1992
1992
Benoxaprofène
(Oraflex®)
Nécrose hépatique
1982
1982
Mibefradil (Posicor®)
Interactions médicamenteuses
multiples
1997
1998
Terfenadine (Seldane®)
Arythmies cardiaques fatales
1985
1998
Dans certains cas la notification spontanée a permis de réviser les
caractéristiques du produit en y incluant les effets indésirables nouvellement
documentés :
DCI
Effets indésirables ajoutés à la
notice
AMM
Révision des
caractéristiques
Cyclophosphamide
Nécrose épidermique
Erythème multiforme
Syndrome de Stevens Johnson
1995
2001
Losartan
Vasculite
Purpura allergique (+Henoch-
Schoenlein)
Choc anaphlactique
Réaction anaphylactoïde
1995
Levofloxacine
Torsades de pointes
1997
2000
Ces exemples montrent combien l’observation des praticiens et la notification
ont permis d’éviter la survenue de mortalité et morbidité iatrogène. Le succès
de la pharmacovigilance dépend de la participation active des professionnels
de santé (médecins, pharmaciens, assistants médicaux, infirmiers, dentistes, …)
et surtout de leur engagement à notifier spontanément les effets secondaires
liés à l’usage des médicaments.

5
Comment faire la notification spontanée
Vous pouvez notifier à partir de la fiche de notification ou si vous n’en avez pas
sur une feuille simple.
Remplissez les 4 rubriques requises et renvoyez-la au Centre National de
Pharmacovigilance :
LE PATIENT
L’EFFET INDESIRABLE
LE(S) MEDICAMENT(S)
LE NOTIFICATEUR
Déclarez tous les médicaments, les vaccins, les produits sanguins, les
dispositifs médicaux, et les produits à base de plante pris par le patient.
Vérifiez qu’il a effectivement pris les médicaments listés. Vérifiez que l’effet
est survenu après la prise du médicament et pas avant. Mentionnez : le nom
commercial, le numéro de lot, la dose, la fréquence, la voie et le site
d’administration, la date de la prise et le motif d’utilisation. Décrivez la
chronologie d’apparition de l’effet par rapport à la prise médicamenteuse
et précisez si l’effet diminue/disparaît après arrêt/diminution de la dose du
médicament.
Décrivez-le au mieux. Soyez simple clair, précis et concis. Evitez les
abréviations. Pensez à préciser : la date de l’événement, la date de la
notification, les éventuels examens complémentaires ayant permis de
confirmer l’effet, les éventuels antécédents médicaux du patient, les
éventuelles causes pouvant expliquer l’événement.
Toutes les données permettant d’apprécier les actions possibles du
médicament et d’éliminer les diagnostics différentiels probables : l’identité,
l’âge, le sexe, le poids et la taille.
Quelle que soit votre profession, vous pouvez être notificateur. Indiquez votre
identité, votre adresse, votre numéro de téléphone votre profession et votre
qualification.
 6
6
 7
7
 8
8
1
/
8
100%