La résistance génétique aux nématodes gastro

La résistance génétique des moutons aux strongles gastro-intestinaux
Académie Vétérinaire de France
18 décembre 2008
Jacquiet P., Barillet F., Bouix J.
François D., Moreno C.,
Terefe G.
INRA
Départements
Santé Animale
Génétique Animale

La résistance génétique des ovins aux
strongles gastro-intestinaux (SGI)
• Contexte général
• Les strongles gastro-intestinaux chez leurs hôtes
• QTL et gènes candidats
• Intérêts et mise en œuvre pratique de la sélection
d’animaux résistants
• Les limites potentielles de la sélection
• Perspectives

Contexte général
Molécules chimiques
Résidus
Écotoxicité
Résistance des SGI
17 fermes des Pyrénées Atlantiques sur 18 étudiées en 2002
présentaient de la résistance aux benzimidazoles
(J. Cabaret et C. Sauvé, communication personnelle)

Éliminer les strongles gastro-intestinaux
Emploi raisonné des anthelminthiques
Fourrages bio-actifs
Augmenter la résistance
de l’hôte
Vaccination
Apports protéiques
Résistance génétique
Tarir les sources
de contamination
Gestion des pâturages
Champignons nématocides ?
Alternatives ?

Résilience
= maintien du niveau de productions en dépit de la présence des vers
Résistance
= diminution de l’installation, du développement, de la fécondité
et de la survie des vers
Effets
pathogènes
Réponse
immunitaire
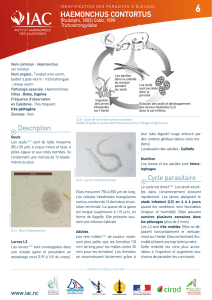
Haemonchus contortus
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
1
/
35
100%