présentation du Dr Emmanuelle Barouk-Simonet

Prédisposition héréditaire au
cancer du sein et de l’ovaire
EPU Biarritz
26/09/2014
Dr Emmanuelle BAROUK-SIMONET
Unité d’oncogénétique Dr Michel LONGY

Le cancer est une maladie toujours génétique
mais rarement héréditaire
(5 à 10% des cas)
Car il résulte de l’accumulation dans une cellule de mutations
qui touchent des gènes contrôlant la prolifération cellulaire
*fow
*1233
@
@
#
a
jfd,s;
yezue
7
Dans la majorité des cas
c’est « l’environnement » qui est
responsable …
Mais dans le cas des formes héréditaires
(prédisposition génétique au cancer)
une mutation est présente dès la conception
au niveau d’un ovule ou d’un spermatozoïde anomalie constitutionnelle
H. Sobol DU Oncogénétique

Génétique somatique ≠ Génétique constitutionnelle
Accumulation d’évènements
mutationnels
Phénomène multi-étapes
Transmissible à travers la
mitose
Anti-oncogènes / oncogènes
Carcinogénèse
Transmission mendélienne (autosomique
dominant ou récessif)
Anti-oncogènes / oncogènes
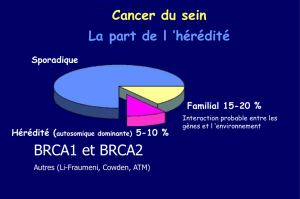
Cancer héréditaire (5 à 10 %)

Consultation d’ oncogénétique
•Démarche volontaire
•Courrier explicatif préalable à la consultation
•Recueil des informations médicales personnelles et familiales (CR histologiques
et opératoires +++)
•Apparentés au 1°, 2° et 3° degré
• Long (≈ 1 heure)
•Arbre généalogique

 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
1
/
41
100%